Содержание:
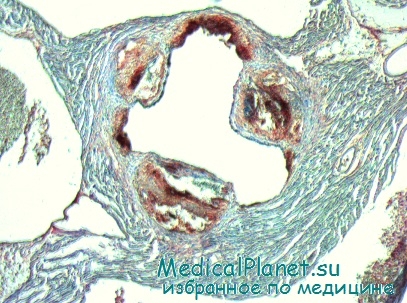
Как показали B.C. Жданов и другие исследователи, в детском и молодом возрасте в коронарных артериях происходит мышечно-эластическая гиперплазия интимы. По мере увеличения возраста гиперплазия интимы может прогрессировать, и в интиме формируется фиброзный или фиброзно-эластический слой.
Эти участки коронарных артерий являются основой для развития атеросклеротических бляшек. Стенозирование просвета коронарных артерий в значительной мере зависит не только от интенсивности развития атеросклероза, но и от выраженности фиброзного слоя в основании атеросклеротических бляшек: средняя толщина этого слоя при наличии резко стенозирующих бляшек существенно больше, чем у основания незначительно стенозирующих бляшек.
Следовательно, формирование стенозирующего атеросклероза коронарных артерий, являющегося основой развития ишемической болезни сердца, находится в тесной зависимости от выраженности гиперпластических изменений интимы в детском и молодом возрасте, и склонность к стенозированию коронарных артерий закладывается уже в детском возрасте.
Известно, что у лиц мужского пола степень гиперплазии интимы в коронарных артериях выражена в большей степени, чем у лиц женского пола. В эпидемиологических патоморфологических исследованиях разных популяций детского и взрослого населения выявлена четкая прямая зависимость между степенью гиперплазии интимы коронарных артерий у детей и выраженностью атеросклероза и частотой коронарной болезни у взрослых.
Некоторые авторы предполагают, что развитие гиперплазии интимы в коронарных и других артериях может быть обусловлено генетическими предпосылками. Установлена прямая зависимость между размерами плода в момент рождения и частотой ишемической болезни сердца и мозговых инсультов у лиц среднего и старшего возраста.
Большая частота этих заболеваний выявлена у лиц, имевших при рождении небольшие размеры, низкую массу тела и гипотрофию. Приведенные данные указывают на важное значение профилактических мероприятий в развитии атеросклероза и ишемической болезни сердца еще до рождения, до зачатия ребенка, затем в период беременности, а также в раннем детском возрасте.
Фиброзно-мышечная дисплазия (ФМД) — это заболевание неизвестной этиологии, определяется как утолщение артериальной стенки от фиброза и мышечной гиперплазии, в результате возникает мультифокальный стеноз артерий. Он был впервые описан в 1938 году Leadbetter и Burkland
Первоначально было описано сужение почечной артерии от ФМД, связанной с вазоренальной гипертензией. Почечные артерии поражаются наиболее часто, поэтому на них приходится до 80% всех случаев. Внутренняя сонная артерия является следующей наиболее часто поражаемым сосудом (впервые описано Connett и Lansche в 1965 году). ФМД встречается в 1% всех каротидных ангиограмм. Женщины более часто поражаются в соотношении 3:1. Болезнь включает в себя средние и мелких артерии, однако, она была описана практически в каждом сосуде. Почечные и сонные артерии одномоментно страдают у 30% пациентов, а позвоночные артерии страдают до 10% у пациентов с каротидной ФМД. Фиброзно-мышечная дисплазия, как правило, клинически представлена в третьем-шестом десятке лет. Клиническая картина зависит от пораженного сосуда, и она похожа на атеросклероз сосудов. поскольку стеноз буде причиной острой или хронической ишемии, или дистальной эмболизации.
Фиброзно-мышечная дисплазия может иметь двусторонний характер, но в отличие от атеросклероза, проявляется, как правило, не в стенозах устьев и она не влияет на бифуркации артерий, поскольку возникает в более дистальных отделах. Классические ангиографическая и ультразвуковая картина представляет собой «нитку из бисера». Теперь точно известно и признано, что при данной патологии существует три вида:
- Тип I (80%) — серии стенозов чередуются с участками дилатации. На гистологии это, как правило, находят медиальную фиброплазию.
- Тип II (15%) — единичный или мультифокальный тубулярный стеноз. Обычно это вызвано фибропалзией интимы. Этот тип более вероятно может привести к диссекции или окклюзии сосуда.
- Тип III (5%) — одна стенка артерии подвержена истончению, что может привести к формированию истинной мешотчатой аневризмы
Картина болезни. Что обычно происходит из-за атипичной фиброзно-мышечной дисплазии
Девяносто процентов ФМД наблюдается у женщин. Оно обычно включает в себя дистальную треть почечной артерии, проходящей в сегментарные ветви. ФМД почечных сосудов является одной из причин гипертензии вследствие стеноза и снижения почечной перфузии. Почки производит повышенные уровни ренина и ангиотензина, что приводит к повышению системного артериального давления и нормализации почечного кровотока.
Пациент находится в группе риска побочных эффектов неконтролируемой гипертонии, таких как инфаркт и инсульт. Во внутренней сонной артерии, ФМД чаще всего расположена на 3-4см от каротидной бифуркации, хотя заболевание обычно заканчивается за пределами черепа. Экстракраниальная ФМД может протекать бессимптомно, но может привести к дистальной эмболизации и быть причиной транзиторной ишемической атаки или инсульта. Также она может быть связана с множеством неспецифических симптомов, таких как головокружение, головная боль, шум в ушах, головокружения, визуальные нарушения или нарушений равновесия. В отличие от почечной ФМД она может быть связано с диссекцией внутренней сонной артерии. До 50% пациентов с экстракраниальной фиброзно-мышечной дисплазией могут быть связаны с внутричерепной аневризмой, а две трети этих внутричерепных аневризм обычно множественные. Кроме того, пациенты с внутричерепной аневризмы должны быть оценены для исключения этой же патологии в сонных и почечных артериях. ФМД в подвздошной артерии может привести к перемежающейся хромоте. Высокий индекс подозрения будет очевидным при оценке молодых пациентов в возрасте до 50 лет, особенно у женщины с перемежающей хромотой нижних конечностей. Дифференциальная диагностика ФМД должна рассматриваться наряду с другими редкими причинами хромоты, такие как кистозная дегенерация адвентиции подколенной артерии, синдром «ловушки» подколенной артерии и окклюзии сосуда среднего калибра при гиперкоагуляции. Дистальная эмболизация является необычным осложнением при ФМД и, как правило, незначительна, вызывая очаговые инфаркты кожи. Она редко приводит к острой ишемии ноги. Может произойти аневризматическое расширение сосуда, так как это может компенсаторно сгладить очаговый стеноз, но последнее может привести к окклюзии сосуда. Клиника при ФМД висцеральных артерий может протекать как в проявлении острой, так и хронической ишемии брыжейки, а также создавать «брыжеечную жабу», или сегментарный инфаркт кишечника.
Методы визуализации фиброзно-мышечной дисплазии
Дуплексное ультразвуковое исследование является полезным в оценке циркуляции сонных артерий и может определить выявить синдром «нитки с бисером» дистальнее бифуркации из-за стенозов и зоны дилатации. Дистальные отделы внутренней сонной артерии, наиболее часто поражаются и сложности могут возникнуть при диагностике болезни во время УЗИ, если поражение расположено чуть ниже основания черепа, что ведет к ложно отрицательному результату. При наличии истории болезни, КТ или магнитно-резонансная ангиография (МРА) будут полезны, чтобы определить заболевание и подтвердить диагноз.
Дуплексное сканирование также полезно при оценке почечного кровообращения, где вычисляется индекс почечной резистивности. Это требует трансабдоминального и поясничного доступа для оценки васкуляризации почек. Было показано, что УЗИ полезно для мониторинга результатов чрескожной ангиопластики как для атеросклеротического стеноза почечной артерии, так и для пациентов с ФМД.
КТ может быть полезной для диагностики внутричерепных аневризм, связанных с каротидной ФМД. КТ ангиография также может получить изменения, характерных для ФМД. Тем не менее, разрешение методов ограничено и окончательный диагноза рекомендуется устанавливать на цифровой ангиографии, и осуществляется, если намечается какое-либо чрескожное вмешательство.
МРТ также может быть использовано для диагностики интракраниальных аневризм. МР ангиография позволяет выявить поражения указывающих на фиброзно-мышечную дисплазию. Разрешение может быть улучшено с контрастированием гадолинием. Артефакт движения ухудшает имидж и движения глотания могут создать ложное появление «нити бисера». Чтобы избежать ошибочных диагнозов, крест-секционные изображения всегда должны быть рассмотрены на рабочей станции.
Патоморфологическая классификация
Гистологическая классификация ФМД основывается на изменении в слое артериальной наиболее пострадавшей стенки. Первоначально болезнь классифицируется как медиальная, интимальная, пери-адвентициальная и периартериальная, совсем недавно добавлены еще подклассификации, которые включают медиальную фиброплазию, перимедиальную фиброплазию и медиальную гиперплазию.
Дифференциальная диагностика ФМД включает, атеросклероз, артериальные воспалительные заболевания (например, болезнь Такаясу) или поражение сосудов нейрофиброматозом. Фиброзно-мышечная дисплазия связана с другими заболеваниями, включая синдром Элерса-Данлоса IV типа и дефицит альфа-1-антитрипсина.
Лечение
Самое раннее лечение ФМД было хирургическим. При открытой хирургии, было принято проводить артериотомию и дилатировать стенозированный проход градуированными расширителями. Вазоренальная гипертензия, ассоциированная с ФМД почечной артерии, успешно лечилась этим методом. Хирургия, однако, имеет высокий риск осложнений и теперь используется при неудачной ангиопластики или, когда болезнь распространяется на другие отделы сосудов. Хирургия остается методом выбора для связанных с болезнью аневризматическими расширениями. Современные хирургические результаты являются более чем приемлемыми с успешностью до 97% с улучшением или излечением от гипертонии.
Фиброзно-мышечная дисплазия почечных артерий
Терапевтическое лечение будет первой линии для ФМД почечной артерии, которая вызывает гипертонию. При лечении гипертонии следует придерживаться стандартных рекомендаций. Показания к реваскуляризации включают в себя:
- неспособность контролировать артериальное давление, несмотря на полипрагмазию;
- появление гипертонической болезни;
- непереносимость гипотензивных препаратов;
- падение почечного размер/объем, несмотря на лечение;
Большинство опубликованные данные относятся результатам интервенционного лечения. Лучшие долгосрочные исходы для эндоваскулярного лечения ФМД, вызванных медиальной фиброплазией, которая так же эффективна, как открытые операции, но с более низким числом осложнений. Чрескожная ангиопластика является первой линии для лечения вазоренальной гипертензии, обусловленной фиброзно-мышечной дисплазией. Немедленные радиологические показатели успеха были зарегистрированы у 83-100% пациентов.
Долгосрочные наблюдения также показывают хорошие результаты, но катамнестические данные трудно интерпретировать из-за различий в отчетности. Наиболее важная клиническая конечная точка к эффективному снижению систолического и диастолического артериального давления. Лечение (восстановление нормотензии без необходимости гипотензивные препараты) достигается почти у 60% пациентов. Чрескожная ангиопластика является процедурой не без риска и распространенность осложнений варьируется от 0-28%. Большинство осложнений являются незначительными, связаны с пункцией сосудов или возникновением сегментарного почечного инфаркта. Артериальная перфорация может быть спровоцирована проводником, но полный разрыв сосуда большая редкость.
С помощью дуплексного сканирования можно оценить результат ангиопластики почечных артерий, и она показывает в последующем риск рестеноза между 10-25%. Повторить ангиопластику технически проще при ФМД, чем проведение первичной процедуры, поскольку она связана с меньшим риском перфорации сосуда или разрыва. Размещение стента в почечной артерии требуется редко даже при повторной ангиопластике, и в настоящее время, редко применяется первичное стентирование сосудов почек при ФМД.
ФМД может стать причиной гипертонии в детском возрасте. Лечение следует тем же путем, как и у взрослых, но результаты чрескожной транслюминальной ангиопластики кажется более благоприятной, чем при других причинах стеноза почечной артерии, таких как артериит. Первоначальные результаты зависят от подобных факторов, таких как длина и сложность поражения. Рестеноз возникает в до 30%, с более высокими темпами, чем у взрослых пациентов с реноваскулярной ФМД.
Фиброзно-мышечная дисплазия сонной артерии
Каротидная ФМД также предварительно обрабатывается перед открытой операцией на сонных артериях, в том числе проводиться ангиопластика. При поражении дальше 3-4см от каротидной бифуркации хирургический доступ может быть сложным. Из-за этих проблем, есть явная привлекательность для чрескожного вмешательства, которая также стала методом выбора для симптоматического лечения ФМД внутренней сонной артерии. Сонные артерии имеют более высокий риск диссекции и, следовательно, более вероятно, что будет необходима установка стента. В настоящее время уделяется интерес к использованию устройств защиты головного мозга, чтобы снизить риск инсульта, связанный с этой процедурой.
Поражение в других областях
ФМД может повлиять на различные области артериальной циркуляции и представлять типичные симптомы, происходящие при атеросклеротическом поражении. При раннем возрастном проявления симптомов и отсутствии привычных факторов риска атеросклероза следует заподозрить ФМД. УЗИ сосудов и ангиография обеспечивает окончательный диагноз, а чрескожная ангиопластика обычно является методом выбора для первичного лечения.
Владельцы патента RU 2513194:
Изобретение относится к области медицины, в частности к неврологии, и может быть использовано для выявления развития гиперплазии неоинтимы и рестеноза сонных артерий после ангиореконструктивных операций на них у больных с прогрессирующим церебральным атеросклерозом без использования ангиовизуализации. Больному с прогрессирующим церебральным атеросклерозом после проведения ангиореконструктивных операций на сонных артериях не более чем через 6 месяцев иммуноферментным методом определяют в сыворотке крови содержание биомаркера липопротеин-ассоциированной фосфолипазы A2 (Lp-PLA2) и при значении его уровня 360 нг/мл и более выявляют развитие гиперплазии неоинтимы и рестеноза в оперированной сонной артерии. Способ обеспечивает высокую точность выявления развития гиперплазии неоинтимы и рестеноза у больных с прогрессирующим церебральным атеросклерозом после ангиореконструктивных операций на сонных артериях.
Изобретение относится к области медицины, в частности к неврологии, и может быть использовано для выявления развития гиперплазии неоинтимы и рестеноза сонных артерий после ангиореконструктивных операций на них у больных с прогрессирующим церебральным атеросклерозом.
Ежегодно в мире умирает 60 млн человек, из них 18 млн — от цереброваскулярных заболеваний (ЦВЗ), причем эти показатели в России одни из самых высоких в мире [Conrado J. Estol. Atherosclerosis: The XXIst Century Epidemic. Stroke, 2011; 42: 3338-39].
Атеросклероз сосудов дуги аорты, особенно бифуркации общей сонной артерии, является причиной более трети ишемических инсультов [Инсульт: диагностика, лечение, профилактика. Под ред. З.А.Суслиной, М.А.Пирадова. — 2-е изд. М., 2009. — 288 с.]. Современные методы обследования значительно облегчили диагностику и увеличили выявляемость атеросклеротических поражений магистральных артерий головы, что наряду с низким уровнем профилактики атеросклероза привело к росту операций на сонных артериях. Окклюзионные заболевания сонных артерий, которые не были подвергнуты хирургическому лечению, дают от 5 до 12% новых инсультов [Inzitari D., Eliasziw М., Gates P. et al. The causes and risk of stroke in patients with asymptomatic internal-carotid-artery stenosis, North. American. Symptomatic Carotid Endarterectomy Trial Collaborators, N. Eng. J. Med., 2000; 342:1693-1700]. Эффективность каротидной эндартерэктомии (КЭАЭ) в предупреждении инсультов у пациентов с атеросклерозом бифуркации сонной артерии достоверно установлена [Barnett H.J., Taylor D.W., Eliasziw М. et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis, NEJM, 1998; 339:1415-1425]. В настоящее время КЭАЭ является стандартом в реваскуляризации головного мозга, тогда как сравнимая с КЭАЭ эффективность и безопасность каротидной ангиопластики со стентированием (КАС) не может считаться абсолютно доказанной. Количество оперативных вмешательств на артериях, кровоснабжающих головной мозг, неуклонно увеличивается. Общее число операций при стенозах сонных артерий за 2011 год выросло на 15%. Самой частой операцией явилась КЭАЭ (по данным ежегодного отчета о работе сосудистых отделений в Российской федерации за 2011 год, опубликованного на сайте ).
С увеличением количества прооперированных больных возникла проблема своевременного выявления развития гиперплазии неоинтимы и рестеноза после ангиореконструктивных операций на сонных артериях.
Известен способ выявления развития гиперплазии неоинтимы и рестеноза после ангиореконструктивных операций артерий, в том числе сонных, у больных с прогрессирующим церебральным атеросклерозом путем клинического наблюдения за состоянием пациентов и выполнения цветового дуплексного сканирования в пери- и отдаленном послеоперационном периодах для контроля за структурными и гемодинамическими изменениями в области вмешательства. Причем динамику изменений в стентированных артериях необходимо выполнять с периодичностью: для позвоночных артерий в сроки 1-3 дня после эндоваскулярного вмешательства, через 3, 6, 12 месяцев и затем ежегодно; для сонных и подключичных артерий — в первые 1-3 дня после операции, через 6, 12 месяцев и далее ежегодно (Чечеткин А.О. Комплексная оценка атеросклеротического поражения ветвей дуги аорты на этапах рентгенэндоваскулярных вмешательств, Автореферат диссертации на соискание ученой степени доктора медицинских наук, Москва, 2012, 48 с.).
Однако данный метод ультразвукового динамического исследования пациента после ангиореконструктивных операций связан с наличием в поликлинических условиях дорогостоящей аппаратуры и отсутствием возможности выявления риска опасного развития стеноокклюзирующих поражений. Данный источник информации рассмотрен в качестве ближайшего аналога.
Задача настоящего изобретения состоит в выявлении нового предиктора развития гиперплазии неоинтимы и рестеноза, доступного для широкого использования. Данная задача решалась определением биохимического показателя — липопротеин ассоциированной фосфолипазы A2 (Lp-PLA2), анализ изменений которого в сопоставлении с клиническими параметрами дает характеристику активности воспалительной реакции сосудистой стенки, развития гиперплазии неоинтимы и рестеноза после ангиореконструктивных операций. Это вызвано тем, что Lp-PLA2 синтезируется преимущественно макрофагами сонных артерий и, проникая в общий кровоток, связывается с циркулирующими в плазме атерогенными частицами ЛПНП и гидролизует фосфатидилхолин с образованием лизофосфатидилхолина и окисленных свободных жирных кислот, которые участвуют в развитии воспалительной инфильтрации в области поврежденного эндотелия и потенцируют синтез цитокинов, что позволяет считать его важным показателем риска развития гиперплазии неоинтимы и рестеноза сонных артерий.
Технический результат предложенного нами способа выявления развития гиперплазии неоинтимы и рестеноза сонных артерий после ангиореконструктивных операций у больных с прогрессирующим церебральным атеросклерозом заключается в том, что лабораторный мониторинг показателя воспалительной реакции сосудистой стенки и атеросклероза липопротеин-ассоциированной фосфолипазы A2 (Lp-PLA2) позволяет с высокой точностью выявить развитие гиперплазии неоинтимы и рестеноза в результате повышения его значений у лиц с прогрессированием стенозирующего процесса во внутренней сонной артерии.
Технический результат достигается тем, что после проведения ангиореконструктивной операции на сонной артерии не более чем через 6 месяцев иммуноферментным методом определяют в сыворотке крови больного содержание биомаркера липопротеин-ассоциированной фосфолипазы A2 и при значении его уровня 360 нг/мл и более выявляют развитие гиперплазии неоинтимы и рестеноза в оперированной сонной артерии.
Способ осуществляется следующим образом.
Больному с прогрессирующим церебральным атеросклерозом после проведения ангиореконструктивной операции (в частности, КЭАЭ или КАС) не более чем через 6 месяцев осуществляют забор крови для исследования из локтевой вены утром натощак после 12-часового голодания. Образцы крови центрифугируют и определяют методом иммуноферментного анализа на ридере Perkin Elmer Victor2 (США) концентрацию Lp-PLA2. Результаты выражаются в нг/мл.
Определение осуществляют твердофазным неконкурентным, основанным на прямой «сэндвич»-технологии методом. При этом в покрытых стрептовидином ячейках микропланшета стандартные пробы и образцы пациентов инкубируют вместе с биотинилированными моноклональными антителами к Lp-PLA2 и антителами к Lp-PLA2 антигену, конъюгированными пероксидазой хрена. После промывания ячеек буферным раствором в каждую ячейку добавляют хромогенный субстрат (3,3.5,5-тетраметилбензидин) для ферментативной реакции. В процессе реакции развивается голубая окраска, интенсивность которой прямо пропорциональна количеству Lp-PLA2. Интенсивность окраски измеряют на микропланшетном ридере с добавлением стоп-раствора на длине волны 450 нм.
При значении данного биомаркера 360 нг/мл и более, что на 180% больше относительно порогового значения (группой экспертов пороговым значением Lp-PLA2 принято считать 200 нг/мл) [Colley KJ, Wolfert RL, Cobble ME. Lipoprotein associated phospholipase A(2): role in atherosclerosis and utility as a biomarker for cardiovascular risk. EPMA J. 2011 Mar; 2(l):27-38. Epub 2011 Mar 10] выявляют развитие гиперплазии неоинтимы и рестеноза в оперированной артерии.
Обследовано 56 пациентов с прогрессирующим церебральным атеросклерозом (38 мужчин, 18 женщин), подвергшихся ангиореконструктивным операциям по поводу стеноза ВСА, находившихся на стационарном лечении в сосудистом отделении НЦН РАМН, средний возраст составил 65 (47; 80) лет. Пациенты были разделены на 2 группы. В I-ю группу (n=23) вошли пациенты, которым была выполнена КЭАЭ, во II-ю (n=35) — КАС. Обследование проводилось в 2 этапа. Как на 1-м, так и на 2-м этапах всем больным проводили общеклиническое обследование, дуплексное сканирование магистральных артерий головы (ДС МАГ) на аппарате Philips iu2 для определения степени прогрессирования атеросклероза. Для исследования содержания маркера воспалительной реакции сосудистой стенки (Lp-PLA2) у данных больных производился забор крови из локтевой вены натощак через 5-6 месяцев после КЭАЭ и КАС. Также содержание Lp-PLA2 было определено у десяти лиц без прогрессирующего церебрального атеросклероза (группа 3) и у 10 лиц с прогрессирующим церебральным атеросклерозом, без стеноокклюзирующего атеросклеротического поражения ВСА (группа 4), сопоставимых по полу и возрасту. Статистический анализ полученных результатов проводился с помощью пакета компьютерных прикладных программ Statistica 6,0 (StatSoft, 2003). Статистически достоверными считались результаты при p Изобретение относится к медицине. Сущность способа определения липидов заключается в том, что к 10 мл хлороформного экстракта липидов добавляют 25 мкл 10% раствора тезита при одновременном перемешивании смеси с помощью шейкера при 20°C и частоте колебаний платформы 120 в минуту в течение 30 минут получают прозрачный раствор липидов для ферментативного определения триацилглицеридов.