Содержание:
В тех случаях, когда недостаточное поступление железа в организм не отражается на уровне гемоглобина в крови, его называют скрытым железодефицитным состояниш, если же содержание гемоглобина у взрослого мужчины снижается до 130 г/ л, а у женщин — до 120 г/л, ставят диагноз железодефицитной анемии (анемий разных видов много). Помимо падения концентрации железа и железосодержащих белков в плазме крови, последняя часто сопровождается снижением количества эритроцитов в крови, изменением их формы и величины. Уменьшается и цветной показатель, указывающий на обеднение эритроцитов гемоглобином (гипохромная анемия).
Клиническими признаками анемии являются: слабость, утомляемость, частые головные боли, летающие «мушки» перед глазами, особенно при резком повороте головы или изменении положения туловища, ощущение онемения конечностей. Больной склонен к обморокам, при незначительной физической нагрузке возникают сердцебиение и одышка. Аппетит снижен, возможны тошнота и извращение вкуса. Изменяется внешний облик. На анемичную девушку не скажешь «кровь с молоком», она «бледна, печальна, молчалива, как лань лесная боязлива», часто раздражительна и плохо спит. Кожа может приобретать желтушный оттенок, она сухая; волосы тусклые, ломкие, выпадают; на ногтях можно заметить поперечную исчерченность и ложкообразные вдавливания.
Не всегда облик больного полностью соответствует описанному, но недостаток железа, как правило, проявляется общим упадком сил, снижением сопротивляемости к простудным и другим заболеваниям.
Анемия развивается у многих больных раком (R. Сох, 1983). Она может отмечаться уже в начальной стадии заболевания. Её степень не всегда соответствует тяжести болезни, но у больных распространёнными формами рака обычно развивается тяжелая анемия (А. П. Кашулина, 1985).
Онкологи считают, что у людей пожилого возраста появление анемии всегда подозрительно на рак. Так, при профилактическом эндоскопическом обследовании 1058 человек с железодефицитной анемией у 92 из них был обнаружен рак. желудочно-кишечного тракта (N. Tzvetkov, 1988).
Причины анемии при раке различны: нарушение всасывания железа и его обмена; незначительная, но хроническая кровопоте-ря; нарушение всасывания меди, кобальта и витаминов, участвующих в кроветворении; угнетающее воздействие злокачественной опухоли на красный костный мозг; уменьшение содержания эритроцитов в крови онкологических больных (Е. И. Слобожанина, 1984) и сокращение продолжительности их жизни (А. П. Кашулина, 1985); уменьшение концентрации гемоглобина в крови (Jako Takeshi, 1987) в результате нарушения его синтеза (W. Т. Beck, 1982) или ускорения распада (C. E. Meroke, 1981); использование эритроцитов крови в качестве питательного субстрата для опухоли (Jako Takeshi, 1987).
Однако и в случаях нормальной концентрации гемоглобина в крови ткани опухоленосителя страдают от недостатка кислорода из-за того, что способность гемоглобина связывать кислород и отдавать его тканям нарушается (R.Manz, 1983). Это является результатом изменения структуры гемоглобина при росте злокачественных новообразований (Б. П. Комов, 1974).
У онкологических больных скрытый или явный дефицит железа обнаруживается постоянно (J. Luez, 1974). Особенно он выражен в случаях метастазирования опухоли, причём тем в большей степени, чем дальше от основного очага метастазы локализуются (A. Griffin, 1965).
Первым признаком рака желудочно-кишечного тракта может быть именно анемия. При раке желудка содержание железа может снижаться уже в начальных стадиях заболевания. Падение его концентрации отмечается при хроническом анацидном гастрите — предраковом заболевании желудка (И. В. Касьяненко, 1972), язвенной болезни желудка с низкой кислотностью желудочного сока, при полипозе кишечники (Г. Л. Александрович, 1964). После успешного лечения заболеваний желудка содержание железа обычно нормализуется. Но если из-за значительного поражения опухолью этот орган был удалён полностью, то и через два года запасы железа не восстанавливаются (Esko Hani, 1985).
Чем объясняется дефицит железа у больных раком?
Увы, дело не только в нескомпенсированной по железу диете.
1. У больных с опухолями или сопутствующими заболеваниями желудочно-кишечного тракта затруднено всасывание железа, особенно если кислотность желудочного сока низкая.
2. Нарушен транспорт железа кровью и доставка его тканям. Установлено, например, что трансферрин крови при росте злокачественных новообразований меньше насыщен железом (В. Е. Ткач, 1973; Т. Наваров, 1979), особенно при раке молочной железы.
3. Затруднено выведение железа из мест депонирования (печень и селезёнка погибших от рака людей зачастую перегружены железом; А. М. 3изум, 1964).
4. Железо поглощается опухолевыми клетками (В. М. Аристархов, 1974). Они активно «изымают» из крови переносящий железо ТРАНСФЕРРИН. Захват его тем значительнее, чем больше масса самой опухоли и чем более она злокачественна (E. Aulbert, 1990). Почему это происходит? Ведь тканевое дыхание — основной потребитель железа в клетке — в раковых клетках слабо! По-видимому, злокачественные клетки с помощью трансферрина маскируются от иммунной системы. Раковые клетки накапливают ферритин (белок, депонирующий железо), причём иногда в таких количествах (например, в раковых клетках молочной железы), что он может играть роль маркёра, т.е. с его помощью можно отличать злокачественное поражение молочной железы от доброкачественного (E. D. Weinberg, 1981).
Избыток железа мешает защите организма от злокачественных клеток, но и его недостаточность также вредна. Железодефицитная анемия предрасполагает к развитию рака.
Обратимся к опытам на животных. У крыс с дефицитом железа в корме опухоли возникали чаще, а перевитые опухоли имели особенно большую массу по сравнению с животными, которых «перегружали» железом (J. Kaibe, 1969). Недостаток железа увеличивал «выход» злокачественных опухолей у крыс, которым вводили канцероген, вызывающий рак печени (H. Yarnashita, 1980).
Что же у человека? Интерес представляют данные эпидемиологических исследованиях, проведенных в Колумбии (S. Broitman, 1981). Эта страна занимает одно из первых мест в мире по частоте рака желудка. Гастроскопическое обследование её жителей, страдающих гастритом с пониженной кислотностью, показало, что у многих из них обнаруживаются характерные для железодефицитного состояния изменения слизистой оболочки желудка, которые считаются предраковыми. Важно также, что при низкой кислотности в желудке увеличивается образование канцерогенных нитрозаминов. Эти результаты говорят о необходимости лечения железодефицитных анемий, поскольку они предшествует возникновению рака желудка (S. Broitman, 1981). Помимо всего прочего, хроническая железодефицитная анемия снижает противоопухолевый иммунитет.
Мы поддерживаем мнение немецких онкологов (R. S. Tandon, 1989), полагающих, что рак является результатом расстройств в организме, вызванных нарушением обмена железа и его дефицитом. Ведь железо — активная часть дыхательных ферментов, и при его недостатке ткани буквально задыхаются, так как не могут усваивать кислород. Чтобы выжить, большинство из них вынуждено переходить на ущербный путь бескислородного (анаэробного) образования энергии, который хотя в какой-то степени покрывает энергетические затраты. А это предрасполагает к развитию рака. Интересно, что у мышей высокораковых линий энергетический обмен сдвигается в сторону анаэробиоза, в то время как у животных, не предрасположенных к развитию рака, преобладает аэробный (с участием кислорода) путь образования энергии.
Железодефицитное состояние излечивается увеличением в рационе доли продуктов, богатых железом (см. табл. 16). Для лечения железодефицитной анемии одной диеты и железистых минеральных вод недостаточно. Необходимо в дополнение к полноценному белковому рациону принимать препараты железа.
Заболеваний от избыточного поступления железа с пищей или приёма препаратов железа через рот (а не путём инъекций) не установлено, но некоторые железосодержащие лекарства могут вызывать тошноту, понос, головную боль и сыпь на коже. В таком случае их заменяют. Внутримышечное введение препаратов железа (равно как переливание крови) может привести к перенасыщению организма железом, поскольку оно очень плохо выводится. Избыток железа, откладываясь в печени и других органах, вызывает их повреждение (гемосидероз).
Помните, что недостаток железа в организме всегда приводит к расстройству здоровья.
… является одним из частых симптомов, сопровождающих течение злокачественных новообразований.
 По определению ВОЗ анемия представляет собой состояние, характеризующееся снижением концентрации гемоглобина: ниже 130 г/л у мужчин и ниже 120 г/л у женщин (такое состояние встречается у онкологических больных, особенно при распространенном процессе).
По определению ВОЗ анемия представляет собой состояние, характеризующееся снижением концентрации гемоглобина: ниже 130 г/л у мужчин и ниже 120 г/л у женщин (такое состояние встречается у онкологических больных, особенно при распространенном процессе).
Злокачественные опухоли легкого и гинекологические раки чаще всего сопровождаются анемией (71 и 63% соответственно).
Причины возникновения анемии у онкологических больных:
• нарушение метаболизма железа;
• кровопотеря;
• гемолиз;
• недостаток питательных веществ (в т.ч., обусловленный синдромом «анорексии-кахексии»);
• нарушение функции почек;
• снижение чувствительности гемопоэтических клеток к эритропоэтину;
• активация иммунной системы опухолевым процессом, что приводит к увеличению концентрации фактора некроза опухоли, интерферона G и интерлейкина-1 в крови и тканях, которые сокращают время жизни эритроцита со 120 до 90–60 сут., нарушают обмен железа, подавляют процесс дифференцировки клеток-предшественников эритроидного ряда и негативно влияют на выработку эритропоэтина – ключевого гормона эритропоэза;
• опухолевая инфильтрация костного мозга, метастатическое поражение костного мозга или индуцированный опухолью фиброз, некроз костного мозга, что ведет к вытеснению костномозговых предшественников и к развитию апластической анемии;
• нежелательные явления, связанные с проведением химиотерапии: повреждение эритроидных предшественников, снижение их реакции на эритропоэтины (использование цитостатических агентов в терапии злокачественных опухолей может не только приводить к угнетению гемопоэза, но и вызывать гемолитические анемии, например, аналоги нуклеотидов).
Порочный круг. Последствия развития анемии для организма заключаются в развитии гемической гипоксии органов и тканей. Снижение гемоглобина и как следствие гипоксия являются факторами риска развития рецидива опухоли. Гипоксия активирует ангиогенез, пролиферацию опухолевых клеток, что приводит к усилению агрессивности опухоли, метастазированию, резистентности к химиотерапии, прогрессированию опухолевого процесса и отрицательно влияет на выживаемость больных. В свою очередь дальнейший быстрый рост опухоли способствует еще большему усугублению регионарной гипоксии вследствие несоответствия ее массы и сосудистой сети; гипоксия способствует активации генов семейства HIF-1, экспрессия которых увеличивает выработку эндотелиального фактора роста (VEGF), что вызывает увеличение ангиогенеза и дальнейший рост опухоли. Гипоксия опухоли почти в 2 раза снижает возможность достижения полной регрессии и длительной выживаемости.
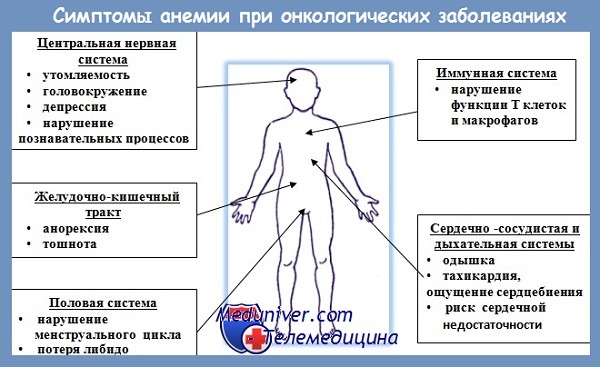
Клиническая картина анемии складывается из нескольких синдромов. У всех больных отмечаются проявления гипоксии: нарастающая слабость, быстрая утомляемость, шум в ушах, потемнение перед глазами при изменении положения тела, головные боли, головокружение, обморочные состояния и сердцебиение при незначительных физических нагрузках, психические явления, бледность кожи и слизистых оболочек, одутловатость лица, трофические нарушения, выпадение волос, усиленное разрушение зубов, сухость кожи, сглаженность сосочков языка; в отдельных случаях – затруднения при глотании (симптом Россолимо — Бехтерева) сухой и твердой пищи; малиновая окраска языка, атрофические изменения слизистой оболочки глотки и пищевода, спастическое сужение верхней части пищевода, ломкость, образование продольной или поперечной исчерченности ногтей, койлонихия.
При дефиците железа к указанной выше картине присоединяются симптомы тканевого дефицита данного элемента: извращение вкуса — рiса clorotica, свидетельствующее о нарушении периферической вкусовой чувствительности. Нередко больные жалуются на мышечную слабость, отмечают ложные позывы на мочеиспускание, неспособность удержать мочу (у детей бывает ночное недержание). Гипоксия и тканевый дефицит железа приводит к расстройствам сердечно-сосудистой и нервной системы, желудочно-кишечного тракта, печени.
Для дефицита витамина B12 характерны желтоватый цвет кожных покровов, диффузная пятнистая коричневая пигментация, анорексия, при выраженном дефиците возможно повышение температуры тела. У половины больных отмечаются явления глоссита – «лакированный язык» — язык лишается сосочков, становится гладким, блестящим. Иногда поражаются слизистые оболочки щек. Возможно развитие диареи. Характерно развитие фуникулярного миелоза – поражения проводящих путей задних канатиков спинного мозга. Возможно также развитие церебральных нарушений, симптомов полиневропатии.
Принципы лечения. Основой лечения любой анемии, связанной с опухолевым процессом, является лечение самой опухоли. Наиболее распространенным методом коррекции анемии при угрожающих жизни состояниях, например, при острой кровопотере, глубокой анемии, является трансфузия донорской эритроцитной массы.
Альтернативные средства лечения анемий зависят от их патогенетического типа. Для анемий, связанных с дефицитом витаминов или железа патогенетической терапией является восполнение такого дефицита.
Для В12 дефицитной анемии достаточной терапией в нетяжелых случаях является введение препаратов этого витамина в дозе 100-200 мкг ежедневно в течение 1 недели с последующим переходом на введение через день до достижения полной гематологической ремиссии (нормализация кроветворения и купирование анемии). В тяжелых случаях (снижение эритроцитов менее 1×10*12/л, неврологическая симптоматика) используется от 300 до 1000 мкг цианкобаламина в течение 2 недель с дальнейшим переходом на поддерживающий режим до достижения стойкой ремиссии.
При дефиците фолиевой кислоты последнюю назначают по 3 мг ежедневно на 1 месяц. При развитии железодефицитной анемии необходимо применение препаратов железа. Коррекция диеты с учетом повышенного содержания в продуктах железа необходима, но недостаточна для лечения развившейся анемии. Для коррекции данного синдрома достаточно поступления в организм от 30 до 100 мг двухвалентного железа в сутки.
Для гемолитических анемий , с учетом иммунного механизма их развития, показано применение глюкокортикоидов. При неэффективности такого подхода используют иммунодепрессанты или спленэктомию. Для лечения данного состояния также используют антигормоны (даназол), моноклональные антитела к лимфоцитам (ритуксимаб, алемптузумаб), иммуноглобулины.Описано также применение методов эфферентной терапии.
( ! ) Новым этапом в лечении хронической анемии злокачественных новообразований, которые связанны с костномозговой недостаточностью, является применение рекомбинантного человеческого эритропоэтина — гемопоэтического фактора роста.
Согласно рекомендациям ESMO (European Society for Medical Oncology) эритропоэтины могут применяться только у больных с анемией, являющейся осложнением химиотерапии. Начало терапии возможно при гемоглобине ниже 100 г/л (анемия >1 ст.) или при анемии 1 ст., сопровождающейся выраженной клинической симптоматикой.
Несмотря на то, что к настоящему времени эритропоэтины стали важным компонентом лечения анемии, но все же вопросы остаются. Например, в 1/3 случаев анемии, которая вызвана химиотерапией, не удается добиться ответа на лечение эритропоэтином, а у остальных ответ на лечение может проявиться через несколько недель. Также остается открытым вопрос о влиянии эритропоэтинов на показатели выживаемости, поскольку проведенные исследования дали противоречивые результаты.
Основные целями назначения эритропоэзстимулирующих препаратов (резолюция экспертного совещания по использованию эритропоэзстимулирующих препаратов в онкологии от 03.11. 2007):
(1) повышение концентрации гемоглобина до целевых значений и ее поддержание;
(2) снижение потребности в гемотрансфузиях;
(3) повышение качества жизни пациентов.
( ! ) До назначения эритропоэтинов следует исключить другие причины анемии: кровотечение, дефицит железа и витаминов (В12, фолиевой кислоты), гемолиз и др.
При снижении концентрации гемоглобина менее менее 80 г/л необходимо рассмотреть целесообразность гемотрансфузий наряду с назначением эритропоэзстимулирующих препаратов, при назначении эритропоэтинов оценить наличие индивидуальных факторов риска развития тромботических осложнений.
Целевой концентрацией гемоглобина является 120 г/л ( ! превышать целевую концентрацию гемоглобина не рекомендуется). После достижении целевой концентрации гемоглобина дозу эритропоэзстимулирующего препарата снижают до минимальной эффективной дозы.
Дозы эритропоэтинов и их модификация (рекомендации European Organization for the Research and Treatment of Cancer – EORTС, 2006):
• дарбэпоэтин-a: 1 раз в 3 нед в фиксированной дозе 500 мкг или в расчетной дозе 6,75 мкг/кг;
• эпоэтин-a и -b: 3 раза в неделю в расчетной дозе 150 ЕД/кг или 1 раз в неделю в фиксированной дозе 40 000 МЕ (эпоэтин-a) или 30 000 МЕ (эпоэтин-b).
При скорости увеличения гемоглобина, превышающей 10 г/л за 2 недели или 20 г/дл за 4 недели, рекомендуется снизить дозу эритропоэтина в соответствии с инструкцией.
Результаты последних международных исследований показали необходимость использования внутривенных форм железа с гемостимулирующей терапией эритропоэтина для лечения анемии, возникшей на фоне химиотерапии. Одновременно существуют указания на эффективность внутривенного железа в монотерапии при функциональном его дефиците. Это явилось основанием для включения в международные рекомендации (NCCN, ESMO) по проведению гемостимулирующей терапии у онкологических больных внутривенных форм железа. При отсутствии дефицита железа (ферритин >800 нг/мл и насыщение трансферрина 20%) вводить его не рекомендуется, как и пациентам с признаками активной инфекции. Целевой уровень гемоглобина при лечении анемии не должен превышать 12,0 г/дл (120 г/л), его достижение сопровождается улучшением качества жизни пациентов и, возможно, результатов противоопухолевого лечения и выживаемости. Недавно в клинической практике появился новый препарат для внутривенного введения — железа карбоксимальтозат (феринжект), показавший высокую эффективность как в комбинации с эритропоэтином, так и в монорежиме. Феринжект не требует проведения тест-дозы, обладает хорошей переносимостью и минимальным риском развития аллергических реакций.
При отсутствии ответа на терапию, что определяется как повышение концентрации гемоглобина менее чем на 10 г/л за 4–6 недель при отсутствии положительной динамики со стороны симптомов анемии, рекомендуется увеличить дозу в соответствии с инструкциями по медицинскому применению эритропоэтина. Продолжать терапию более 6–8 недель при отсутствии эффекта, несмотря на повышение дозы, нецелесообразно. Одновременное назначение внутривенных препаратов железа значительно повышает эффективность эритропоэтина. После завершения химиотерапии лечение эритропоэз-стимулирующими препаратами целесообразно продолжить в течение времени, равного продолжительности 1–2 циклов химиотерапии.
Анемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях.
Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии.
Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли.
В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию.
Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.
Патогенез анемий при опухолях
При опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин.
Такая «не спровоцированная» анемия может определяться гиперпродукцией провоспалительных цитокинов (ИЛ-1, ФНО и ИФН-у) при опухолевых заболеваниях. Повышение концентрации этих соединений обычно наблюдается при заболеваниях, сопровождающихся хроническим воспалением, например при ревматоидном артрите, и также сопровождается анемизацией. Возникающая при этом анемия называется анемией опухолевого или хронического заболевания.
Отрицательное влияние анемии на качество жизни
При исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л.
Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом.
Снижение эффективности противоопухолевого лечения при анемии
Анемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена.
Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани.
Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам.
Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли.
Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже.
На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли.