Содержание:
Патогенез инфаркта миокарда имеет несколько факторов своего развития. Основными факторами являются следующие:
- Коронаротромбоз, представляющий собой острую закупорку просвета артериальных сосудов сердца. Этот процесс приводит к образованию крупноочагового, трансмурального некроза мышечного слоя сердца — миокарда.
- Коронарный стеноз представляет собой сужение внутреннего артериального просвета сосудов, вызванное разбухающей бляшкой холестерина с крупноочаговым инфарктом.
- Стенозирующий распространенный коронарный склероз, представляющий сужение внутреннего просвета нескольких сердечных артериальных сосудов, возникающий на фоне миокардитического склероза, который провоцирует мелкоочаговый субэндокардиальный инфаркт.

Последний из факторов по своим клиническим проявлениям отнюдь не является мелким. При развитии последнего фактора летальность инфарктов в значительной мере возрастает. Схема развития заболевания включает в себя несколько этапов, основными среди которых являются нарушение процесса обеспечения питания сердечной мышцы, развитие некротических явлений и образование соединительнотканных рубцов на поверхности или в толще миокарда. Инфаркт миокарда в этиологии имеет несколько этапов развития.
О симптомах и лечении нестабильной стенокардии читайте здесь.
Что такое инфаркт и какова его этиология?
Инфаркт представляет собой недуг, который обусловлен возникновением некроза участка мышечного слоя сердца, появляющегося в результате возникновения острой ишемии, связанной с закупориванием внутреннего просвета ветви коронарных артериальных сосудов образующимся тромбом.
 Иногда возможно развитие инфаркта в результате возникновения спазма коронарной артерии, закупорки ее внутреннего просвета эмболом или атеросклеротической бляшкой. Также возможно развитие инфаркта как следствие разрыва коронарного артериального сосуда.
Иногда возможно развитие инфаркта в результате возникновения спазма коронарной артерии, закупорки ее внутреннего просвета эмболом или атеросклеротической бляшкой. Также возможно развитие инфаркта как следствие разрыва коронарного артериального сосуда.
Инфаркт можно рассматривать как осложнение, возникающее в результате развития различных недугов, сопровождающихся появлением острых коронарных недостаточностей. Так, например, закупорка сердечной артерии тромбом или эмболом возможна при развитии эндокардита и при некоторых типах пороков сердца, которые являются осложненными внутриполостными тромбозами. Закупорка возможна при развитии коронарита, при системном артрите. Однако чаще всего инфаркт возникает у пациента на фоне атеросклероза сердечных артерий. Сегодня принято рассматривать инфаркт как самостоятельное заболевание. Этот недуг является очень серьезным и наиболее тяжелым типом ишемической болезни сердца.
Патогенез инфаркта
Образование некротического участка мышцы сердца при развитии инфаркта всегда обусловлено развитием гипоксии, которая возникает вследствие прогрессирования ишемии из-за снижения и прекращения кровотока по артериальному сосуду, обеспечивающему снабжение кровью определенного участка сердечной мышцы.
 Чаще всего патогенез процесса закупоривания артериального сосуда практически полностью совпадает с патогенезом тромбоза кровеносного сосуда на поверхности фиброзной бляшки. Не всегда существует возможность установления конкретных причин развития инфаркта миокарда у больного.
Чаще всего патогенез процесса закупоривания артериального сосуда практически полностью совпадает с патогенезом тромбоза кровеносного сосуда на поверхности фиброзной бляшки. Не всегда существует возможность установления конкретных причин развития инфаркта миокарда у больного.
Очень часто наблюдаются возникновение и прогрессирование инфаркта в результате оказания на организм высокого физического, психологического или эмоционального напряжения. В любом из вариантов прогрессированию недуга способствуют высокая активность в работе сердца и выброс в кровяное русло гормонов, вырабатываемых надпочечниками. Эти процессы сопровождаются активированием процессов свертываемости крови. При усилении сократительной активности сердечной мышцы возрастает потребность в кислороде, а турбулентное перемещение крови в области сосуда, где происходит формирование бляшки, способствует формированию тромба.
Недуг сопровождается сбоями при выполнении сердцем своей функции перекачивания крови.
В случае развития обширного инфаркта миокарда может развиваться острая левожелудочковая сердечная недостаточность, кардиогенный шок. Смерть при таком развитии недуга может наступить через несколько минут после прекращения кровоснабжения по коронарной артерии. Наиболее частой причиной летального исхода в период острого развития недуга является процесс фибрилляции желудочков.
 Предпосылки развития разнообразных типов аритмий при инфаркте появляются как следствие нарушения последовательности распространения возбуждающего импульса по мышечному слою сердца. Дело в том, что некротизированные участки миокарда возбуждение проводить неспособны. Помимо этого, электронестабильность ткани в области некроза провоцирует развитие очагов неконтролируемого возбуждения. Эти очаги служат источниками экстрасистолии, тахикардии и фибрилляции сердечных желудочков.
Предпосылки развития разнообразных типов аритмий при инфаркте появляются как следствие нарушения последовательности распространения возбуждающего импульса по мышечному слою сердца. Дело в том, что некротизированные участки миокарда возбуждение проводить неспособны. Помимо этого, электронестабильность ткани в области некроза провоцирует развитие очагов неконтролируемого возбуждения. Эти очаги служат источниками экстрасистолии, тахикардии и фибрилляции сердечных желудочков.
Попадание в кровь продуктов некротизирования миокарда вызывает образование под контролем иммунной системы аутоантител, которые воспринимают продукты, получающиеся при некротизации миокарда, как чужеродные белки. Эти явления способствуют развитию постинфарктного синдрома.
Патологическая анатомия недуга
Чаще всего недуг выявляется в левом желудочке сердца. При наступлении летального исхода (спустя несколько часов или суток после прекращения кровообращения по коронарной артерии) в толще миокарда четко выявляется зона ишемического некроза, имеющая неправильные очертания и кровоизлияния, располагающиеся по периметру очага. Помимо этого, выявляются очаги разрушения мышечных волокон, которые окружаются скоплениями лейкоцитов.
 В результате прогрессирования заболевания, начиная с четвертого дня после возникновения недуга, в очагах некроза формируются фибробласты, которые представляют собой родоначальников соединительной ткани, формирующей с течением времени на начальном этапе нежный (а спустя 60 дней — плотный) рубец. Формирование такого образования, как постинфарктный рубец, как правило, полностью завершается спустя 6 месяцев после начала развития заболевания. В этот период развивается так называемый постинфарктный кардиосклероз. Развивающийся некроз миокарда способен охватывать всю толщу этого сердечного слоя на пораженном участке. Такой тип инфаркта носит название трансмурального, может располагаться ближе к внутренней или внешней оболочке сердца.
В результате прогрессирования заболевания, начиная с четвертого дня после возникновения недуга, в очагах некроза формируются фибробласты, которые представляют собой родоначальников соединительной ткани, формирующей с течением времени на начальном этапе нежный (а спустя 60 дней — плотный) рубец. Формирование такого образования, как постинфарктный рубец, как правило, полностью завершается спустя 6 месяцев после начала развития заболевания. В этот период развивается так называемый постинфарктный кардиосклероз. Развивающийся некроз миокарда способен охватывать всю толщу этого сердечного слоя на пораженном участке. Такой тип инфаркта носит название трансмурального, может располагаться ближе к внутренней или внешней оболочке сердца.
Иногда возможны изолированные инфаркты, развивающиеся в перегородке между желудками. В случае распространения нарушения на перикард возникают признаки развития фибринозного перикардита. При повреждении эндокарда могут появляться тромбы, которые провоцируют развитие эмболий артерий большого круга кровообращения. Достаточно часто заболевание провоцирует развитие аневризмы сердца. Из-за возникновения непрочности сердечной мышцы в месте ее некротизации возможно возникновение разрывов, что способно спровоцировать прободение перегородки между желудочками.
Эпидемиология инфаркта сердца
ИМ является достаточно распространенным заболеванием, которое часто приводит к смертельному исходу. В последнее время наметилась тенденция к снижению смертности от ИМ. Часто инфаркт может встречаться у людей в более молодом возрасте. Инфаркт в возрасте 35-50 лет встречается чаще у мужчин, чем у женщин. Пиковое развитие числа ИМ у человека приходится на возраст от 50 лет.
Эпидемиология инфаркта миокарда включает в себя факторы риска, которые можно разделить на управляемые и неуправляемые.
 Управляемыми факторами риска являются следующие:
Управляемыми факторами риска являются следующие:
- курение;
- повышенный уровень общего холестерина;
- пониженная физическая активность;
- избыточность массы тела;
- период менопаузы;
- употребление в большом количестве спиртных напитков;
- стрессовые ситуации.
Неуправляемыми факторами являются:
- пол больного;
- возраст больного;
- семейное развитие ранней ИБС;
- перенесенный ранее ИМ;
- тяжелая степень стенокардии;
- коронарный атеросклероз.
Очень большое значение при развитии инфаркта придается нарушениям, связанным с коронарным кровообращением и спазмом сердечных артериальных сосудов. Помимо этого, большое значение оказывается усилению тромбообразующих характеристик крови.
Кардиомиопатия такоцубо: особенности течения и лечения

Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день.
Кардиомиопатия такоцубо (или стресс-индуцированная кардиомиопатия) является разновидностью неишемической кардиомиопатии, при которой происходит внезапное преходящее снижение сократимости сердечной мышцы. Во многом проявления этого заболевания – боль в области сердца и затрудненность дыхания – схожи с признаками инфаркта миокарда. Их появление провоцируется сильным психоэмоциональным или физическим стрессом (например, внезапной смертью родственника, известием о раковом заболевании, астматическим приступом).
Именно поэтому заболевание и получило такие названия как «синдром разбитого сердца» и «кардиомиопатия такоцубо». В первом варианте название отображает причину развития патологии: сильный стресс или переживания. Во втором случае название появилось в связи с тем, что в переводе с японского слово «tako-tsubo» является названием приспособления для ловли осьминогов и при таком виде кардиомиопатии форма левого желудочка приобретает форму этого предмета, представляющего собой керамический горшок с шарообразным основанием и узким верхом.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Кардиомиопатия такоцубо относится к разряду редких форм кардиомиопатий, но в последние годы специалисты отмечают тенденцию к увеличению количества пациентов с таким недугом. В этой статье мы предоставим вам информацию о причинах, распространенности, особенностях течения, методиках выявления и лечения синдрома разбитого сердца.
Немного истории
 Пристрастие к алкоголю и курение — факторы, повышающие риск развития кардиомиопатии такоцубо
Пристрастие к алкоголю и курение — факторы, повышающие риск развития кардиомиопатии такоцубо
Впервые этот недуг сердца был описан в 1991 году группой японских ученых – доктором H. Sato и его соавторами. Именно они дали ему название «кардиомиопатия такоцубо», так как форма патологически измененного левого желудочка при таком заболевании напоминала используемое японскими рыбаками приспособление для ловли осьминогов – tako-tsubo. Именно этот симптом позволял отличать рассматриваемый синдром от инфаркта миокарда. При такой форме кардиомиопатии левый желудочек становится похожим на tako-tsubo и в систолу его верхушка не сокращается, а его базальные отделы одновременно сокращаются чрезмерно.
Широко известной кардиомиопатия такоцубо стала уже в 2006 году благодаря обсуждению этой темы на проведенном в Барселоне Европейском конгрессе кардиологов. С тех пор ученые стали уделять больше внимания изучению механизмов ее развития. Пока до конца изучить эти стороны заболевания специалистам не удалось.
Причины
Пока ученые предполагают, что синдром разбитого сердца развивается под воздействием следующих факторов:
- сильный стресс и интенсивные психоэмоциональные переживания: известие о тяжелом заболевании, смерть родственника, несчастные случаи и т. п.;
- превышающие возможности организма физические нагрузки: внезапное тяжелое заболевание, астматический приступ и пр.
Механизмы развития такой кардиомиопатии пока неясны. Существует несколько теорий патогенеза: транзиторный вагоспазм, микрососудистая дисфункция, заворачивающаяся левая передняя нисходящая артерия. Однако ни одна из них еще полностью не доказана. Наблюдения больших групп людей с кардиомиопатией такоцубо показали, что у многих из них недуг развивался именно на фоне интенсивного стресса (эмоционального или физического). Однако примерно у трети больных такие факторы отсутствовали.
Наблюдения европейских специалистов показали, что несколько чаще кардиомиопатия такоцубо развивается именно зимой. Такой факт может объясняться двумя вероятными причинами:
- в холодное время года чаще происходит спазм мелких ветвей коронарных сосудов;
- в осенние и зимние месяцы люди чаще переносят вирусные заболевания.
Предполагается, что выбухание верхушки левого желудочка происходит из-за повышения уровня катехоламинов в крови. Полностью механизм развития такого недуга пока не выяснен. Ученые полагают, что наиболее вероятную роль играет появляющийся в момент стресса выброс адреналина, который провоцирует спазм сосудов и резко ухудшает качество микроциркуляции в сосудах сердца. В результате у больного возникают преходящие нарушения функционирования левого желудочка, проявляющиеся свойственными инфаркту миокарда изменениями на ЭКГ и в анализах крови.
Наблюдения специалистов показывают, что кроме психоэмоциональных и физических стрессов, способствовать развитию синдрома разбитого сердца могут следующие предрасполагающие факторы:
- постоянный источник психотравмирующих ситуаций в семье или на работе;
- интенсивный болевой синдром;
- пристрастие к алкоголю или никотиновая зависимость;
- гиперлипидемия;
- резкое снижение артериального давления;
- проведение процедур или хирургических операций (например, сердечный стресс-тест).
Распространенность
Кардиомиопатия такоцубо намного чаще обнаруживается у представительниц прекрасного пола. По наблюдениям специалистов, средний возраст пациенток с таким недугом составляет 61-76 лет. У женщин, которым уже исполнилось 55 лет, риск развития такой патологии в 4,8 раза выше, чем у тех, кто не достиг этого возрастного рубежа. Предполагается, что такой факт указывает на то, что чаще синдром разбитого сердца развивается у пожилых женщин, у которых понижается уровень эстрогенов и ткани сосудов и сердца становятся более чувствительными к воздействию гормонов стресса. Данные статистики так же подтверждают это предположение: в более чем 90% случаев синдром разбитого сердца возникает у женщин именно в постменопаузе.
Кардиомиопатия такоцубо может выявляться даже у детей. Этот факт объясняется тем, что дифференцировка надпочечников длится до 14-16 лет, и в этот период гормональной нестабильности организм может некорректно реагировать на стресс.
Симптомы
 Кардиомиопатия такоцубо клинически сходна с инфарктом миокарда. Отличить эти патологии друг от друга поможет коронарография
Кардиомиопатия такоцубо клинически сходна с инфарктом миокарда. Отличить эти патологии друг от друга поможет коронарография
Проявления синдрома разбитого сердца во многом схожи с симптомами острого инфаркта миокарда. Самыми частыми признаками такого недуга являются загрудинные боли, наблюдающиеся у 59% пациентов, и одышка, проявляющаяся у 30% больных. Кроме этого, такая форма кардиомиопатии может сопровождаться приступами тахикардии и периодическими обмороками.
При проведении обследования у больных с кардиомиопатией такоцубо выявляются следующие симптомы:
- боли в области сердца после любых перегрузок (психоэмоциональных или физических);
- ишемические изменения на ЭКГ;
- отсутствие признаков проходимости коронарных сосудов или незначительные нарушения функционирования артерий сердца;
- повышение уровней креатинкиназы-МВ и/или тропонина.
Особенности течения
Проблема своевременного диагностирования этой формы кардиомиопатии состоит в том, что результаты анализов крови и ЭКГ почти идентичны с проявлениями инфаркта миокарда. Отличить синдром разбитого сердца от этого частого заболевания можно только по результатам коронарографии, которая показывает, что артерии сердца остаются здоровыми и гемодинамически значимое сужение этих сосудов отсутствует.
Опубликованные в журнале European Heart Journal результаты наиболее значимых исследований этой формы кардиомиопатии показали, что примерно 1,7-2,2% инфарктов миокарда на самом деле являются кардиомиопатией такоцубо. У большей половины пациентов с таким заболеванием приступу предшествует интенсивный стресс и у 74% больных повышается уровень катехоламинов. Отмечается, что по сравнению с нормальными показателями при кардиомиопатии такоцубо уровень этих гормонов способен повышаться в десятки раз.
Осложнения
Кардиомиопатия такоцубо может осложняться следующими состояниями:
- остановка сердца;
- брадиаритмия;
- тахиаритмия;
- кардиогенный шок;
- выраженная митральная регургитация;
- инсульт;
- верхушечное тромообразование.
Развитие острой сердечной недостаточности при синдроме разбитого сердца возрастает при присутствии следующих факторов:
- снижение фракции выброса левого желудочка менее 40%;
- присутствие физического стрессора;
- возраст старше 70 лет.
Диагностика
Для выявления кардиомиопатии такоцубо назначаются следующие исследования:
- ЭКГ – обнаруживаются типичные для острой сердечной недостаточности изменения, проявляющиеся в нарушениях ритма, ритмичности и скорости сокращения стенок желудочков сердца (восстановление показателей ЭКГ при синдроме разбитого сердца происходит через 2-3 недели заболевания);
- Эхо-КГ – выявляется дискинез или акинез средней части и верхушки левого желудочка на фоне апикального и базального гиперкинеза, всегда определяется характерное изменение очертаний левого желудочка, иногда присутствует обструкция выходного тракта левого желудочка;
- коронарография – в отличие от острой коронарной недостаточности гемодинамически весомые стенозы коронарных артерий отсутствуют;
- МРТ – введение гадолиния показывает, что контраст не накапливается трансмурально или субэндокардиально, как при миокардитах и инфарктах миокарда;
- анализ сердечных сывороточных маркеров – повышение уровней креатинкиназы-МВ и/или тропонина обнаруживается у большинства (примерно у 89%) пациентов.
Лечение
 Синдром разбитого сердца — показание для экстренной госпитализации в стационар
Синдром разбитого сердца — показание для экстренной госпитализации в стационар
При выявлении признаков кардиомиопатии такоцубо пациент должен в срочном порядке госпитализироваться в стационар. Пока нет четких рекомендаций по лечению такой формы кардиомиопатии. Если развитию заболевания предшествовал сильный стрессовый фактор, то больному в острой стадии показан прием транквилизаторов. При наличии выраженных болей и других провоцирующих факторов, которые способствовали развитию недуга, показано их устранение.
Так же пациентам с кардиомиопатией такоцубо назначаются следующие снижающие нагрузку на миокард препараты:
- бета-адреноблокаторы;
- ингибиторы АПФ;
- мочегонные;
- антагонисты кальция;
- органические нитраты;
- антиагреганты;
- антикоагулянты.
При выявлении динамической обструкции выходного тракта левого желудочка в план медикаментозного лечения включают средства положительного инотропного действия.
При кардиомиопатии такоцубо может быть показано проведение баллонной внутриаортальной контрпульсации.
Длительность приема лекарственных средств определяется скоростью восстановления функций левого желудочка. Первые признаки улучшения работы сердца появляются через несколько дней, а на фоне поддерживающей медикаментозной терапии сердце обычно полностью восстанавливается на протяжении первых 2-х месяцев.
Прогноз
Для большинства пациентов прогноз синдрома разбитого сердца благоприятный. Летальность при такой патологии составляет не более 1,1%. Рецидивы кардиомиопатии такоцубо наблюдаются у 5% пациентов.
При проведении своевременного лечения тяжелые осложнения развиваются редко: у 1,5% больных может наступать кардиогенный шок, у 4,2% развивается мерцательная аритмия.
К какому врачу обратиться
При возникновении болей за грудиной, одышки, эпизодов тахикардии и периодически возникающих обмороках следует обратиться к кардиологу. После проведения ЭКГ, Эхо-КГ и коронарографии врач сможет дифференцировать кардиомиопатию такоцубо от других проявлений острой коронарной недостаточности и назначит необходимое лечение.
Кардиомиопатия такоцубо относится к редким формам кардиомиопатий и чаще развивается на фоне сильного эмоционального или физического стресса. В последние годы такая патология обнаруживается все чаще. Ее проявления практически идентичны с признаками острого инфаркта миокарда, и отличить эти два заболевания можно только после проведения коронарографии. Тактики лечения этих двух болезней сердца также во многом схожи и подразумевают применение транквилизаторов для устранения стрессовых факторов и препаратов, обеспечивающих снижение нагрузки на сердечную мышцу.
О синдроме разбитого сердца в программе «Жить здорово!» с Еленой Малышевой:
| Патогенетическое звено | Лабораторные и клинические проявления |
| 1. Дефицит энергии: | |
| 1) Нарушение сократимости 2) Нарушение расслабления 3) Активация гликолиза, снижается рН 4) Нарушение обменных процессов | 1) Систолическая дисфункция + 2) Диастолическая дисфункцияÞ сердечная недостаточность 3) Болевой синдром 4)Дистрофия миокарда |
| 2. Нарушение работы ионных насосов Þ дисбаланс ионов и жидкости: | |
| 1) Дисбаланс К, Nа во вне- и внутриклеточной жидкости 2) Избыток Са в саркоплазме: — ишемическая контрактура — активация протеолиза — активация фосфолипаз и ПОЛ | 1) Нарушение биоэлектрогенеза, аритмии, смещение сегмента SТ 2) -диастолической дисфункции, — ¯ сократимости, дизрегуляция метаболизма миокарда |
| 3. Повреждение мембран и ферментных систем: | |
| 1) Повреждение митохондрий | 1) Усугубление энергодефицита |
| 2) Повреждение мембран СПР | 2) выхода Са в саркоплазму |
| 3) Повреждение лизосомальных и цитоплазматических мембран | 3) Цитолиз Þ резорбционно-некротический синдром: появление (повышение) в сыворотке крови маркёров повреждения миокарда (МВ-КФК, ЛДГ, АсАТ, АлАТ, I- и Т-субъединиц тропонина). Лейкоцитоз, повышается СОЭ. |
Таким образом, коронарная недостаточность представляет собой совокупность ишемического и постишемического реперфузионного синдромов. Некоронарогенные некрозы миокарда могут возникать в результате нарушения обменных процессов в миокарде в связи с действием избытка электролитов, гормонов, токсических продуктов и др. Различают электростероидные, катехоламиновые, гипоксические, иммунные, воспалительные некрозы.
Инфаркт миокарда — одна из клинических форм ишемической болезни сердца, протекающая с развитием ишемического некроза участка миокарда, обусловленного абсолютной или относительной недостаточностью его кровоснабжения. Основной клинический признак — интенсивная жгучая боль за грудиной (ангинозная боль). Однако болевые ощущения могут носить вариабельный характер. Пациент может жаловаться на чувство дискомфорта в груди, боли в животе, горле, руке, лопатке и т. п. Нередко заболевание имеет безболевой характер, что характерно для больных сахарным диабетом. Болевой синдром сохраняется более 15 минут (могут длиться 1 час) и купируется через несколько часов, либо после применения наркотических анальгетиков, нитраты неэффективны. Бывает профузный пот. Патогенез.Различают стадии развития инфаркта миокарда: 1. Ишемии; 2. Повреждения (некробиоза); 3. Некроза; 4. Рубцевания. Ишемия может предшествовать инфаркту и длиться довольно долго. При исчерпывании компенсаторных механизмов говорят о повреждении, при этом страдает метаболизм и функция миокарда, однако изменения носят обратимый характер. Стадия повреждения длится от 4 до 7 часов. Некроз характеризуется необратимостью повреждения. Через 1-2 недели после инфаркта некротический участок начинает замещаться рубцовой тканью. Окончательное формирование рубца происходит через 1-2 месяца. При повреждении и некрозе возникает выход катионов калия и кальция из некротизированных кардиомиоцитов, что обуславливает патологическую разность потенциалов и инфарктоподобную картину на ЭКГ. Болевой синдром обусловлен преимущественно местным ацидозом, гибелью нервных окончаний в зоне инфаркта и связью ряда биологически активных веществ (кининов и др.) с болевыми рецепторами (ноцицепторами). Кардиогенный шокпри инфаркте миокарда — крайняя степень левожелудочковой недостаточности, характеризующаяся резким снижением сократительной способности миокарда (падением ударного и минутного выброса), которое не компенсируется повышением сосудистого сопротивления и приводит к неадекватному кровоснабжению всех органов и тканей, прежде всего — жизненно важных органов. Возникает тяжёлое нарушение сократительной функции миокарда с дополнительным присоединением усугубляющих ишемию миокарда факторов: 1. Активация симпатической нервной системы вследствие падения сердечного выброса и снижения АД приводит к учащению ритма сердца и усилению сократительной деятельности миокарда, что увеличивает потребность сердца в кислороде. 2. Задержка жидкости из-за снижения почечного кровотока и увеличение ОЦК, что усиливает преднагрузку на сердце, способствует отёку лёгких и гипоксемии. 3. Увеличение ОПСС из-за вазоконстрикции, приводящее к увеличению постнагрузки на сердце и увеличению потребности миокарда в кислороде. 4. Нарушение диастолического расслабления левого желудочка миокарда из-за нарушения его наполнения и снижения податливости, что вызывает увеличение давления в левом предсердии и способствует усилению застоя крови в лёгких. 5. Метаболический ацидоз вследствие длительной гипоперфузии органов и тканей. Резорбционно-некротический синдромпри инфаркте миокарда – это клинико-лабораторный симптомокомплекс, в основе которого лежат изменения в крови и во всем организме вследствие некроза кардиомиоцитов. Он включает симптомы: 1. Лихорадка. 2. Лейкоцитоз, нейтрофильный сдвиг влево (в первые 3-5 дней) и анэозинофилия, увеличение СОЭ (с 5-7 дня), то есть — характерный симптом инфаркта миокарда «перекрест» (симптом «ножниц») между числом лейкоцитов и СОЭ, который обычно наблюдается в конце 1-й — начале 2-й недели болезни: лейкоцитоз начинает снижаться, а СОЭ возрастает. 3. Увеличение внутриклеточных ферментов: аспартатаминотрансфераза, аланинаминотрансфераза (АСТ, АЛТ), креатинфосфокиназа (КФК), лактатдегидрогеназа (ЛДГ) структурных белков миоцита (миоглобин, тропонин). 4. Появление C-реактивного белка.
Сердечная астма и отек легких при инфаркте миокардаотличаются особой тяжестью течения. Однако общие их механизмы практически не отличаются от описанных в разделе «Острая левожелудочковая недостаточность».
Нарушение метаболизма при инфаркте миокарда.Помимо изменения активности ферментов, имеющего значение для диагностики заболевания, при инфаркте миокарда происходят изменения в крови, отражающие нарушения углеводного, белкового, липидного обменов, кислотно-щелочного равновесия, электролитного баланса, гормонального профиля и т.д. Нарушение углеводного обмена в острой фазе инфаркта миокарда проявляется в виде гипергликемии, а иногда и гликозурии. Повышение сахара в крови связано с повышением секреции катехоламинов, что усиливает кликогенолиз и тормозит секрецию инсулина. Гипергликемия наблюдается в первые 5-10 дней и в дальнейшем исчезает. Однако в некоторых случаях она отмечается в течение 1-2 месяцев от начала инфаркта миокарда и может указывать на скрыто протекающий сахарный диабет. Расстройство кровообращения в вегетативных нервных центрах также может служить причиной гипергликемии. Нарушения белкового обмена при инфаркте миокарда выражаются в уменьшении в крови количества альбуминов, увеличении содержания α2-глобулинов, гамма-глобулинов, фибриногена, в ряде случаев и α1-глобулинов. На вторые-третьи сутки заболевания появляется положительная реакция на С-реактивный белок, которая держится в течение 1-2 недель и в дальнейшем становится отрицательной. В случае присоединения каких-либо воспалительных осложнений эта проба может оставаться положительной длительное время. Повышения содержания серомукоида в крови имеет место на протяжении первых 10-14 дней заболевания. Нередко при инфаркте миокарда находят повышение уровня остаточного азота в крови до 0,6-0,8 г/л на протяжении первых двух недель. Причиной азотемии при инфаркте миокарда являются различные факторы: нарушения белкового обмена, выход в кровь из тканей азотсодержащих метаболитов, нарушение азотовыделительной функции почек вследствие гемодинамических расстройств. Изменения электролитного баланса при инфаркте миокарда характеризуются повышением содержание в крови калия, кальция, уменьшается содержание железа, цинка. Однако эти изменения чаще незначительны. Общие изменения в организме характеризуются синдромом гипоперфузии органов и тканей, активацией анаэробного гликолиза, метаболическим ацидозом, в тяжелых случаях синдромом полиорганной недостаточности.Нарушения сократительных свойств миокардапри инфаркте характеризуются акинезией в зоне некроза, гипокинезией в окружающем миокарде, часто возникают аритмии (экстрасистолии, пароксизмальные тахикардии, фибрилляция желудочков), может быть острая сердечная недостаточность, асистолия. Нарушения биоэлектрических свойств миокардапри трансмуральном (некроз на всю толщину миокарда) и крупноочаговом инфаркте характеризуются патологической разностью потенциалов, обусловленной большим положительным зарядом зоны некроза за счет значительного выхода калия и кальция из некротизированных кардиомиоцитов и на ЭКГ проявляются патологическим глубоким зубцом Q, повышением сегмента ST и слиянием его с зубцом T, причем при трансмуральном инфаркте зубец R отсутствует, а при крупноочаговом остается:
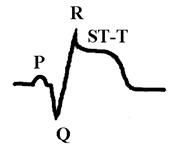
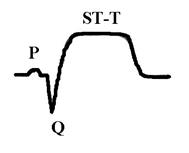
Мелкоочаговый инфаркт миокарда наиболее часто проявляется отрицательным, равнобедренным, острым зубцом T с углублением в динамике:

Недостаточность сердца от перегрузки может быть от перегрузки объёмом, давлением и смешанная. При этом к сердцу с нормальной сократительной способностью предъявляются повышенные требования.
Сердечная недостаточность от перегрузки объемом возникает при заболеваниях, сопровождающихся увеличением притока крови к определенному отделу сердца. Это наблюдается при недостаточности клапанов, выполнении чрезмерной физической нагрузки, эритремии, артериовенозных шунтах и др.
Причинами сердечной недостаточности от перегрузки сердца давлением являются заболевания, при которых увеличивается сопротивление сердечному выбросу крови. Эти состояния возникают при стенозе отверстий сердца, гипертензии большого и малого круга кровообращения, сосудистом спазме, сужении аорты и др.