Электрокардиографический диагноз базируется на изменениях комплекса QRS, которые варьируют в зависимости от области возникновения инфаркта.
Инфаркт переднеперегородочной области. Аналогично инфаркту переднеперегородочной области с блокадой левой ножки пучка Гиса и зубцом q в отведении I, aVL, V5 и V6 обширный инфаркт переднеперегородочной области у больного с искусственным водителем ритма, расположенным в эндокарде правого желудочка, часто вызывает исходные зубцы q в отведении I, II, V5 и V6, приводя к появлению признака, который Castellanos называет St—qR. Такая картина не наблюдается при малых размерах инфаркта переднеперегородочной области. Конфигурация St—qR, возникающая в отведении V5 и V6 помогает диагностировать инфаркт, потому что сокращения, навязанные стимуляцией эндокарда правого желудочка, могут быть представлены конфигурацией qR или Qr в отведении I и aVL даже при отсутствии инфаркта.
Обычно это является результатом изменений в положении катетерного электрода, силы QRS становятся или положительными, или отрицательными в отведении II, III и aVF. В противоположность этому в отведении V5, V6 сокращения, вызванные пейсмекером, никогда не дают конфигурацию qR или Qr при отсутствии инфаркта, хотя часто имеется конфигурация Rs или даже QS. С другой стороны, Magrina и сотр. обнаружили зубец г в отведении V1 длительностью более 0,03 с и аномальное изменение зубца R и правых прекардиальных отведениях у 50% больных с инфарктом передней стенки, но не при инфаркте нижней стенки.
Огромный спайк однополюсного пейсмекера может сместить комплекс QRS так, что исходные зубцы q, наблюдаемые при применении двухполюсного пейсмекера, становятся явными. В других случаях инерция однополюсного спайка может создать ложный зубец Q. По мнению Zoneraich, вектор кардиографический диагноз инфаркта переднеперегородочнои и переднебоковой области под влиянием электростимуляции правой верхушечной области сходен с тем, что наблюдается при блокаде левой ножки пучка Гиса в сочетании с инфарктом.
Инфаркт диафрагмальной стенки. Возникновение измененного зубца г в отведении aVR, как полагает Cardenas, указывает на инфаркт диафрагмальной стенки. Barold придерживается мнения, что такая конфигурация в отведении aVR иногда наблюдается во время электростимуляции правой верхушечной области, в то время как другие авторы сообщают, что они отмечали подобные изменения только у 33% больных с инфарктом нижней стенки.
На ВКХ отмечается ротация петли QRS по часовой стрелке, что иногда является нормой во время электростимуляции правой верхушечной области. Однако при инфаркте диафрагмальной области эфферентная часть петли QRS смещается ниже оси Х и отведениях II, III и aVF.
На хронической стадии изменения сегмента ST—Т не очень важны для диагностики ишемической болезни сердца у больных с электродом в верхушечной области правого желудочка, за исключением отдельных случаев (стенокардия Принцметала). С другой стороны, большие спайки у больных с электростимуляцией, особенно у больных с пейсмекером, синхронизированным с желудочком, могут вызвать ложные токи повреждения.
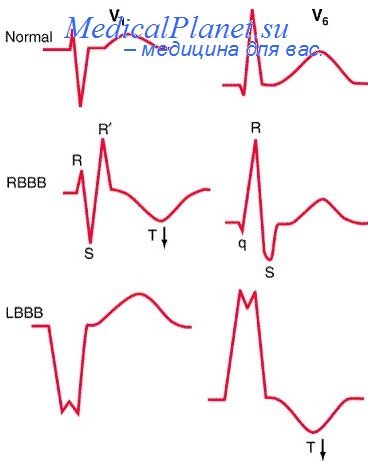
Недавно ценность признака ST—qR была подтверждена Kafka. По мнению этого автора, данный признак обладает очень высокой специфичностью (100%) и малой чувствительностью (10—15%) при инфаркте переднеперегородочной области (отведения I, aVL, Ve) или при инфаркте нижней стенки (отведения II, III, aVF). Возникновение зазубрин в зубце S является также очень специфичным (>90%) и довольно чувствительным (50%) признаком при обширном инфаркте передней стенки, в то время как признак St—rS в отведении aVR является не очень специфичным (15%), но очень чувствительным (>90%) при инфаркте нижней стенки.
По данным векторкардиографии, наличие начальных сил справа и различная ротация в горизонтальной плоскости (по или против часовой стрелки) являются очень специфичными при инфаркте передней стенки, будучи более чувствительными при обширном инфаркте передней стенки (66%), чем при инфаркте переднеперегородочной области (33%).
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ Искендеров Б.Г.
Пензенский институт усовершенствования врачей, кафедра терапии № 1 (зав. — проф. И.П. Татарченко)
Резюме
У 195 больных с острым инфарктом миокарда (ОИМ), осложненным атриовентрикулярной (АВ) блокадой II-III степени, изучалась динамика АВ-проведения, уточнялись сроки и показания для имплантации кардиостимулятора. Из них у 118 больных (60,5%) проводили временную трансвенозную электрокардиостимуляцию (ЭКС), а у 32 больных (16,4%) была произведена операция имплантации кардиостимулятора в сроки от 12 до 25 суток, в среднем через 16,4+/-1,5 суток от начала ОИМ. Показаниями для постоянной ЭКС были: стабильное сохранение АВ-блокад III и II степени (тип 2:1 и далеко зашедшая блокада) более двух недель от начала заболевания и сочетающихся с блокадами ножек пучка Гиса. При соблюдении этих правил стойкое восстановление синусового ритма на фоне постоянной ЭКС наблюдалось лишь у двух больных, а рецидивы АВ-блокады II-III степени после перенесенного ОИМ у больных без постоянной ЭКС были выявлены в 11,2% случаев.
Ключевые слова: острый инфаркт миокарда, атриовентрикулярная блокада, показания к ЭКС, имплантация кардиостимулятoра.
Частота возникновения атриовентрикулярных блокад II и III степени при остром инфаркте миокарда (ОИМ) колеблется от 12 до 20% [6, 7]. Известно, что при передней локализации ОИМ, осложненного полной поперечной блокадой сердца, прогноз значительно хуже, чем при задней локализации поражения и смертность без применения временной трансвенозной электрокардиостимуляции (ЭКС) достигает 80% [4, 5]. Применение метода временной ЭКС в большинстве случаев позволяет вывести больных из состояния брадиаритмического шока, предупредить возникновение приступов Морганьи-Адамса-Стокса и значительно улучшить прогноз [6]. В ряде случаев развившиеся в остром периоде инфаркта миокарда атриовентрикулярные (АВ) блокады могут сохраняться в постинфарктном периоде.
В рекомендациях, предложенных в 1991 году рабочей группой Американской ассоциации кардиологов и Американского колледжа кардиологов (АНА/АСС), АВ-блокады, осложняющие течение ОИМ, выделены в отдельную категорию показаний к постоянной ЭКС [8]. При этом, показаниями к имплантации кардиостимулятора являются как устойчивая, так и преходящая АВ-блокада II-III степени, сочетающаяся с блокадой ножек пучка Гиса, а относительным показанием — устойчивая АВ-узловая блокада. Несмотря на это, данные об оптимальных сроках имплантации кардиостимулятора при 0ИМ противоречивы. Некоторые авторы подчеркивают, что, поскольку ближайший прогноз у данной категории больных в основном зависит от величины некроза миокарда, степени дисфункции левого желудочка и динамики АВ-проведения, постоянная ЭКС должна быть отсроченной [1]. М.Я. Руда и соавт. [5] считают, что, если поперечная блокада сердца, развившаяся как осложнение ОИМ, сохраняется более 4 недель, то это, чаще всего, свидетельствует о ее переходе в постоянную форму и является показанем к имплантации кардиостимулятора. Однако, Ю.Ю. Бредикис [2] рекомендует имплантацию кардиостимулятора через 6-9 дней при сохранении АВ-блокады II-III степени, осложняющей течение ОИМ и сочетающейся с блокадой ножек пучка Гиса.
Целью работы явилось изучение динамики АВ-блокады II-III степени, осложнившей течение ОИМ, уточнение сроков и показаний для имплантации кардиостимулятора.
Материал и методы
За 9 лет работы в блоке интенсивной терапии и реанимации при городском инфарктном отделении из 1652 больных, поступивших с диагнозом ОИМ у 195 (14,7%) диагностировано осложнение в виде АВ-блокады II и III степени (соответственно, у 117 и 78 больных). Возраст больных (108 мужчин и 87 женщин) составил 37-75 лет, в среднем — 64,7+/-4,5 года. Из них у 91 больного (46,7%) был выявлен ОИМ передней локализации и у 104 (53,3%) — задней. АВ-блокала II-III степени чаще сочеталась с задней локализацией ОИМ, реже — с передней (соответственно, в 78.5 и 21,5% случаев). Из 78 больных с АВ-блокадой III степени у 46 (58,9%) диагностирован дистальный тип и у 32 (41,1%) — проксимальный тип. При АВ-блокаде II степени отмечены следующие типы блокады: тип Самойлова-Венкебаха у 54 больных, тип Мобитца у 23 больных, тип 2:1 у 29 больных и далеко зашедшая блокада у 11 больных. У 65 больных (33,3%) АВ-блокада носила перемежающийся характер, преимущественно при задней локализации.
Повторный ОИМ был диагностирован у 71 больного (36,4%), в том числе передняя локализация — у 37 и задняя — у 34. Кроме того, у 23 больных (32,4%) повторный ОИМ развился в области ранее перенесенного инфаркта миокарда, а у 48 больных (67,6%) — в противоположной стенке сердца. Важно отметить, что из числа 71 больного с повторным ОИМ у 15 (21,1%) течение первичного инфаркта миокарда осложнялось преходящими АВ-блокадами. Также из 195 больных у 49 (25,1%) на исходной ЭКГ были выявлены нарушения внутрижелудочковой проводимости, в том числе у 10 больных — билатеральная бифасцикулярная блокада ножек пучка Гиса.
АВ-блокады чаще возникали в период до 6 суток от начала заболевания и в большинстве случаев отягощали течение ОИМ. Так, у 57 больных (73,1%) АВ-блокада III степени сопровождалась острой сердечной недостаточностью (отек легких, кардиогенный шок), в том числе у всех больных с передним и повторным ОИМ. При АВ-блокаде II степени указанное осложнение отмечено в 44,4% случаев. Кроме того, у 45 больных (23,1%) диагностирован синдром Морганьи-Адамса-Стокса с приступами синкопе; у трех из них была фибрилляция желудочков на фоне полной АВ-блокады, а у остальных — асистолия.
С учетом общепринятых показаний у 118 больных (60,5%) проводили временную учащающую трансвенозную ЭКС из верхушки правого желудочка в режиме R-запрещающей стимуляции. У остальных больных эндокардиальный электрод с профилактической целью вводился в правое предсердие. Из них лишь у 7 в дальнейшем возникла необходимость в проведении временной ЭКС. Частота ЭКС в зависимости от тяжести сердечной недостаточности колебалась от 55 до 80 имп/мин.
Продолжительность временной ЭКС у разных больных составила от нескольких часов до 25 суток: при переднем инфаркте миокарда в среднем — 13,1+/-0,8 суток и при заднем — 4,7+/-1,0 суток (р
Имплантация кардиостимулятора вскоре после инфаркта миокарда не увеличивает шансы этих пациентов на выживание. Правильной тактикой является выжидание в течение нескольких месяцев.
Для некоторых страховых компаний это «благая весть»! Ведь им приходиться покрывать стоимость устройства в $25000. Новые стимуляторы исправляют ритм сердца только при необходимости, то есть когда начинается аритмия. Доказано, что у пациентов, перенесших инфаркт миокарда несколько месяцев или лет тому назад, устройство достоверно увеличивает выживаемость. Вживление стимулятора сразу после инфаркта пациенту с ослабленной и поврежденной сердечной мышцей бесполезно. Авторы исследования посвященного этой проблеме советуют врачам выждать минимум 6 месяцев после инфаркта. В США, врачи, как правило, ждут от 1 до 3 месяцев, прежде чем устанавливать стимулятор пациенту, перенесшему инфаркт.
В настоящее время крупнейшая национальная страховая программа Medicare оплачивает имплантацию, которая проводится в течение месяца после инфаркта. Сейчас решается вопрос оплаты стимулятора при его более поздней установке после инфаркта и у пациентов, которым по разным причинам показана имплантация стимулятора, но инфаркта не было. За год Medicare покрывает стоимость 50000 стимуляторов. Предполагается, что к 2007 году понадобится вживление 150 000 – 200 000 стимуляторов, а это $4 млрд. в год. Кстати, компания Johnson & Johnson намерена купить фирму Guidant — крупнейшего производителя стимуляторов в США за $24 млрд.
Так вот в ходе исследования с 627 пациентами, перенесшими инфаркт, половине из них назначали стандартное лечение (аспирин, ингибиторы АПФ и β-блокаторы) для стабилизации артериального давления и статины, препараты, снижающие уровень холестерина. Из них 120 пациентов умерли в течение 2,5 лет после начала исследования. 62 пациента из тех, кому вживляли стимуляторы и 58 проходивших стандартное лечение. Вживление стимулятора снижает риск смерти от нарушений ритма на 60%, но многие пациенты со стимуляторами погибают от повторных инфарктов и от причин не связанных с нарушениями ритма. Непонятно почему погибло больше пациентов со стимуляторами, сами по себе устройства безвредны. Возможно, в группе сравнения стандартная терапия была более агрессивной, и больше пациентов перенесли аортокоронарное шунтирование или стентирование.
Исследователи надеются, что эти и другие сведения заставят врачей пересмотреть общие подходы к срокам и показаниям к имплантации стимуляторов.