Содержание:
Новейшим органосохраняющим методом лечения миомы матки является эмболизация маточных артерий (ЭМА). Эта технология применяется с конца прошлого века. С 1997 года началось активное внедрение ЭМА в повседневную клиническую практику. К 2000 году в мире было осуществлено более 10 000 вмешательств. В нашей стране ЭМА разрешено использовать с 1998 г. согласно приказу № 98 Минздрава России.
ЭМА: показания. техника выполнения
ЭМА практически не имеет ограничений. Ей следует отдавать предпочтение в тех случаях, когда невозможно проведение других органосохраняющих методов (при гигантской миоме матки, больших субмукозных узлах), а также, если операция по удалению матки представляет риск для жизни из-за выраженной сопутствующей патологии пациентки.
Суть метода заключается в том, что в артерии, питающие матку и миому матки, вводят специальное вещество (эмболизат), которое полностью блокирует кровообращение матки. Вследствие этого миоматозные узлы уменьшаются и выделяются потом через шейку матки (рисунок 25). Через полгода матка приобретает нормальные размеры. Следовательно, женщина, которой предстояло удаление матки, может теперь забеременеть и родить ребенка!
Питание матки восстанавливается после ЭМА за счет развития коллатерального кровообращения. Процесс формирования новых сосудов начинается сразу после вмешательства и к году заканчивается полностью.
Эмболизация маточных артерий: 4 этапа
1 этап. Подготовительный. Начинается в палате за 30 минут до процедуры. Пациентке вводят наркотические (промедол) и ненаркотические (трамал) анальгетики, седативные препараты (седуксен, реланиум, димедрол), а также антибиотики широкого спектра действия (цефалоспорины, фторхинолоны, макролиды). После этого женщину отвозят в рентгенологическую операционную, где проводится вмешательство.
2 этап. Ангиография – метод контрастного рентгенологического исследования кровеносных сосудов. Ангиографию сосудов матки проводят непосредственно перед ЭМА в рентгенологической операционной. Для этого используют специальный ангиографический аппарат.
3 этап. Введение эмболизата осуществляется сразу после ангиографии. Лечебный эффект ЭМА основан на особенностях кровоснабжения миоматозных узлов, которые имеют замкнутую артериальную сеть. После введения в маточные артерии эмболизирующее вещество накапливается в сосудах опухоли.
4 этап. Контрольная ангиография. Выполняется для того, чтобы убедиться в остановке кровообращения в сосудах опухоли.
5 этап. Заключительный. После извлечения из бедренной артерии катетера осуществляют остановку кровотечения прижатием рукой в течение 10–20 минут.

Постэмболизационный синдром
После остановки кровоснабжения в опухоли возникает ее некроз (инфаркт), что проявляется соответствующими симптомами, которые выделяют в понятие «постэмболизационный синдром» (ПЭС).
Наиболее частой жалобой после ЭМА является боль в нижних отделах живота различной интенсивности и длительности. С целью облегчения состояния пациенткам сразу после вмешательства назначают наркотические и ненаркотические обезболивающие препараты.
Выраженность болей зависит от диаметра эмболизата (наиболее сильные боли отмечены при использовании мелких эмболов 300 мкм), его общего количества, технике введения препарата, а также от индивидуального порога болевой чувствительности каждой женщины.
Скрывать не стану, большинство пациенток жалуются на очень сильные боли после эндоваскулярного вмешательства. В то же время, есть и такие дамы, которые характеризуют боли как терпимые.
У большинства пациенток после ЭМА повышается температура тела, может возникнуть тошнота, рвота, нарушения мочеиспускания. Нередко женщины жалуются на кровяные выделения из половых путей, которые могут продолжаться 7–10 суток после ЭМА.
После вмешательства необходимо сдать клинический анализ крови, так как в нем могут быть выявлены отклонения: лейкоцитоз, повышение СОЭ.
В связи с этим, обязательным является стационарное наблюдение пациентки в течение 10–14 дней после ЭМА и проведение специального лечения
ПЭС проявляется в ближайшие сутки после проведения ЭМА и длится от одной до 3–4 недель. Все лабораторные показатели окончательно нормализуются в течение 2–3 месяцев после вмешательства.
Куда мигрируют узлы после ЭМА?
Что же происходит дальше с миоматозными узлами, которые уже некротизировались? Давайте проследим за их перемещением.
Проследим путь внутренней (субмукозной) миомы матки. После ЭМА субмукозные узлы (узлы 1а, б) уменьшаются, а затем либо остаются в толще матки, либо перемещаются в полость матки. Если до ЭМА узел лежал поверхностно (1а), то после лечения он может самостоятельно выделиться (экспульсия) и родиться из матки.
Если субмукозный узел исходно имел широкое основание и залегал глубоко в толще матки (1б), после ЭМА он сместится в полость матки, но самостоятельно выделиться не сможет. Его нужно либо открутить механически (миомэктомия), либо вырезать электропетлей (гистерорезекция). Подобные вмешательства обычно выполняют через 6–9 месяцев после ЭМА.
Субсерозные узлы (поверхностные) после ЭМА тоже уменьшаются, а затем (узлы 2 а, б) они либо остаются в толще матки (2а), либо сдвигаются ближе к поверхности матки, их ножка становится тонкой 2б). Узлы на тонкой ножке можно убрать лапароскопическим или лапаротомическим способом. Операцию обычно проводят через 6–12 месяцев после ЭМА.
Интерстициальные узлы, уменьшаясь, чаще остаются в толще стенки матки. Удалять их не нужно.
Этой эндоваскулярной операции в раннем постэмболизационном периоде присущи определенные специфические особенности клинического течения, неправильная трактовка которых приводит к применению неоправданной тактики ведения больных и развитию тяжелых осложнений ЭМА. Все это в конечном итоге может снизить значение этого перспективного метода лечения миомы матки. Быстрой популяризации методики ЭМА и ее стремительному внедрению в клиническую практику лечебных учреждений России в последние 2 года во многом способствовали внешняя техническая легкость и доступность этого эндоваскулярного вмешательства, зачастую сопровождавшиеся неоправданным расширением показаний к ЭМА и выполнением врачами, не прошедшими специальную подготовку.
Отдаленные результаты ЭМА у больных также подтвердили ее высокую клиническую эффективность. В сроки до 1 года после эндоваскулярного вмешательства было отмечено уменьшение размеров миоматозных узлов в среднем с 11,4 до 2,6 см, а матки — с размеров, соответствующих 13,6 нед беременности, до нормального объема. У 96,1% больных полностью исчезли или значительно уменьшились клинические симптомы миомы матки, причем 98,7% пациенток высказали полную удовлетворенность произведенной ЭМА. Достигнутым результатам эмболизации маточных артерий при лечении миомы матки и отсутствию осложнений во многом способствовала тщательная оценка особенностей клинического течения после вмешательства, объединенного в понятие "постэмболизационный синдром", и соответствующая тактика ведения больных, на которые хотелось бы обратить особое внимание.
Было установлено, что наиболее характерными симптомами постэмболизационного синдрома ЭМА являются болевые ощущения, кровяные выделения из половых путей, гипертермия, лейкоцитоз, гиперфибриногенемия, нарушения мочеиспускания, расстройства деятельности желудочно-кишечного тракта, функциональные изменения сердечно-сосудистой системы. Болевые ощущения. Болевой синдром наибольшей интенсивности отмечался при размерах узла более 8 см. По мнению ученых, выраженность болевого синдрома обусловлена 5 взаимосвязанными факторами: 1) размерами миоматозного узла, 2) его локализацией, 3) особенностями строения сосудов перифиброидного сплетения, 4) наличием развитых коллатеральных источников кровоснабжения матки и миоматозного узла, 5) выбором состава и размера частиц эмболизирующего препарата. Считается, что основой развития болевого синдрома и степени его выраженности является не ишемизация самого миоматозного узла, а острое прекращение кровотока в сосудах неизмененного миометрия. Как правило, миомы небольшого размера имеют развитое локальное перифиброидное сплетение, представленное дуговыми и радиальными артериями, огибающими основной узел и отдающими внутрь опухоли слабовыраженную питающую капиллярную сеть. При этом миоматозные узлы либо не сдавливают, либо незначительно сдавливают непораженный мышечный слой, нормально васкуляризированный, с нормальной архитектоникой сосудов. Выявленные особенности кровоснабжения миомы матки в зависимости от ее размеров и локализации, учет степени развития коллатерального кровообращения, тщательный выбор эмболизационного препарата имели большое значение для выработки оптимальной тактики ведения пациенток после ЭМА, а также для исключения фактора "неожидаемых ощущений", что во многом определяло эмоциональное состояние пациенток. В наблюдениях при выраженном болевом синдроме (8-10 баллов по шкале самооценки боли) было необходимо назначать наркотические анальгетики, как правило, 1-2 раза в день вмешательства и на следующее утро. В дальнейшем обезболивание производилось другими препаратами (трамал, анальгин, кеторал) более продолжительное время (7-10 дней). При средней степени выраженности боли (4-7 баллов) было достаточно назначения таких препаратов, как трамал, кеторал. При слабом болевом синдроме назначались баралгин, анальгин, диклофенак.Следует подчеркнуть, что у пациенток с миоматозными узлами большого размера (особенно при их интерстициально-субсерозном расположении) в течение первых 1-3 суток после ЭМА отмечалась выраженная болезненность при пальпации живота, которая, однако, не сопровождалась истинными симптомами раздражения брюшины.
Кровяные выделения. Вторым наиболее значимым симптомом постэмболизационного периода, сопровождающего ЭМА, являются кровяные выделения из половых путей. Они отмечены у 38,6% пациенток, причем у большинства из них имели место интерстициальные или интерстициально-субмукозные узлы. Как правило, эти выделения начинались со вторых суток после ЭМА, их продолжительность составляла от 1 до 6 нед (в среднем 1,3), они носили скудный или умеренный характер, не сопровождаясь анемизацией пациенток с падением уровня гемоглобина. Появление кровяных выделений не зависело от периода менструального цикла при проведении эмболизации. С нашей точки зрения, причиной этих явлений могло быть дренирование в полость матки ишемизированных субмукозных миом. Эти симптомы безопасны, быстро проходят и требуют лишь назначения профилактической антибактериальной терапии. Видимо, целесообразно проводить ЭМА перед ожидаемой менструацией, чтобы добиться временного совпадения этих последствий вмешательства с физиологическим периодом и тем самым устранить их негативное психоэмоциональное воздействие. Несмотря на малую клиническую значимость кровяных выделений из половых путей, сопровождающих проведение ЭМА, они могут приобрести угрожающий характер при выполнении эндоваскулярного вмешательства у больных с гигантскими субмукозными миомами. Это обусловлено следующими причинами. Как непосредственно после ЭМА, так и при наступлении очередной менструации миоматозные узлы большого размера, располагающиеся в полости матки, не позволяют миометрию полноценно рефлекторно сократиться в ответ на происходящее кровотечение, препятствуя его остановке, что может закончиться массивной кровопотерей. Кроме того, субмукозно расположенная миома большого объема (особенно при ее перешеечной локализации) затрудняет эвакуацию из полости матки скопившейся крови. Создавшаяся ситуация потенциально опасна в связи с возможным развитием пиометры и необходимостью экстирпации органа. Поэтому, выполнение ЭМА у больных с гигантскими субмукозными миомами должно быть ограничено строгими показаниями, обусловленными необходимостью сохранения органа и отсутствием других альтернативных способов лечения. Кровяные выделения из половых путей после ЭМА у 5% больных являются симптомами начинающейся спонтанной экспульсии субмукозных миом. В большинстве случаев эвакуирующаяся миома (особенно небольших размеров) выходит спонтанно в первые часы после развития характерного симптомокомплекса. К нему могут относиться появление схваткообразных болей внизу живота, усиление серозных выделений из половых путей и даже появление гноевидного отделяемого из влагалища. Как правило, после трансвагинальной экспульсии отмечается полное восстановление "архитектуры" матки. Однако, если эвакуирующаяся миома матки не выделяется в первые 24-36 ч после появления клинических симптомов, мы считаем целесообразным применение гистероскопии с последующим удалением отторгнувшихся миоматозных узлов с целью профилактики инфекционных осложнений.
Гипертермия. У 145 (94,8%) пациенток, перенесших ЭМА, в постэмболизационном периоде было отмечено появление гипертермии, которая обозначается как невыраженную при температуре 37,1-37,5°С, среднюю — при 37,6-38,0°С, и выраженную — при подъеме температуры более 38,1°C. Лишь у 5,2%, участвующих в исследовинии больных, температура тела после ЭМА не превышала нормальных значений в течение всего времени наблюдения. В 81,7% наблюдениях температурная реакция характеризовалась в основном повышением температуры до субфебрильных цифр в течение 2-5 суток (в среднем 4,7). У 13,1% пациенток (у всех с узлами больших размеров) температура тела достигала 38,2-38,5°С и держалась в течение 2-4 суток, затем критически снижалась до субфебрильных цифр, сохраняясь, однако, на протяжении 2 недель. Эта клиническая составляющая постэмболизационного периода ЭМА является наиболее объяснимой, поскольку в течение ближайшего времени после вмешательства отражает лишь генерализованную реакцию организма в ответ на острую ишемию ткани миомы. При этом необходимо учитывать (особенно у больных с субмукозной миомой матки), что устойчивое сохранение гипертермии в сочетании с другими симптомами (гноевидные выделения из половых путей, лейкоцитоз и др.) может свидетельствовать об экспульсии узла в полость органа и неблагоприятном клиническом течении. В таких случаях, учитывая опасность развития пиометры, считается целесообразным применение активной хирургической тактики, направленной на удаление отторгнутого узла.
Лейкоцитоз. Отражением описанных клинических симптомов постэмболизационного периода служили показатели анализов крови, наиболее значимым из которых являлся уровень лейкоцитов. В наших наблюдениях у подавляющего большинства наблюдаемых, несмотря на выраженный болевой синдром и гипертермию у части из них, число лейкоцитов не превышало 11·109/л (невыраженные изменения). Лейкоцитоз до 14·109/л отмечен у 20,9% больных. И только у 3,9% пациенток число лейкоцитов превышало 14·109/л, достигая критических значений 21·109/л. Необходимо подчеркнуть, что при ЭМА в остром постэмболизационном периоде сочетание выраженного лейкоцитоза с гипертермией, выделениями из половых путей и болезненностью при пальпации живота не всегда свидетельствуют о неблагоприятном течении заболевания, требуют выжидательной тактики консервативной терапии в течение 1-3 суток и большой осторожности при определении показаний к экстренным хирургическим вмешательствам.
Гиперфибриногенемия. Изменения лабораторных показателей системы гемостаза, в первую очередь гиперфибриногенемия, наблюдались у 7,2% женщин, перенесших ЭМА. Скорее всего подобный феномен связан со стандартным ответом системы гемостаза на производимую закупорку артериальных стволов и развивающийся тромбоз сосудов матки. После ЭМА замедление или прекращение кровотока в маточных артериях вызывает выраженное снижение кровенаполнения матки и соответственно резкое замедление сброса крови через внутренние подвздошные вены. В отсутствие других составляющих классической триады Вирхова, определяющей факторы развития венозного тромбоза, это ухудшение кровотока в венах не носит угрожающего характера, потенциально опасного развитием тромбоэмболии легочной артерии. Однако у пациенток с нарушениями свертывающей системы крови, а также при наличии комбинированной патологии глубоких вен нижних конечностей или тазовых вен, либо имеющих другие факторы, провоцирующие развитие ТЭЛА, к ЭМА следует относиться с известной степенью настороженности и проводить комплекс профилактических мероприятий (назначение антикоагулянтных и дезагрегантных препаратов, компрессионное бинтование нижних конечностей и др.).
Дизурия. Изменения функции органов мочеиспускания после ЭМА отмечены у 22,9% больных. Они проявлялись незначительным дискомфортом (болезненность, рези, никтурия) при мочеиспускании у 7,2% из них (слабая степень расстройства), нарушением мочеиспускания у 14,4% больных, что потребовало катетеризации мочевого пузыря в течение первых суток после ЭМА (средняя степень), стойкой задержкой мочи более 2 суток — 1,3% больных (выраженная степень). Как было установлено, клинические симптомы дизурических явлений после ЭМА зависели от особенностей кровоснабжения органов малого таза и техники выполнения эндоваскулярного вмешательства. В наших наблюдениях у 24,8% больных при селективном рентгеноконтрастном исследовании выявлены крупные артериальные ветви, отходящие от ствола маточных артерий в области ее устья и питающие верхнюю стенку мочевого пузыря в дополнение к основной мочепузырной артерии. Очевидно, что при выполнении ЭМА из устья маточной артерии могло произойти попадание частичек эмболизационного препарата в указанные артериальные ветви с последующим развитием преходящей острой ишемии верхней стенки мочевого пузыря, развитием ее пареза и последующей дизурии. Аналогичная ситуация могла возникнуть и при чрезмерном введении эмболизата во время ЭМА, когда после закупорки основного ствола маточной артерии ретроградный выброс частичек ПВА приводит к закупорке пузырной ветви маточной артерии. Схожий с описанным ранее механизм непреднамеренного ишемического поражения отмечается и при возникновении сниженной сексуальной функции после ЭМА, связанной с частичной потерей чувствительности влагалища и обусловленной закупоркой влагалищной ветви маточной артерии. Этот феномен был отмечен у 2,6% больных, перенесших эндоваскулярное вмешательство. Тщательная оценка особенностей кровоснабжения органов малого таза, специфической ангиоархитектоники маточной артерии, соблюдение техники эндоваскулярного вмешательства и применение методики суперселективной катетеризации, исключающей попадание частиц эмболизационного препарата в несоответствующие ветви маточной артерии, является залогом предотвращения указанных негативных последствий ЭМА. Перечисленные проявления постэмболизационного синдрома являются наиболее специфическими для эмболизации маточных артерий при лечении миомы матки. Вместе с тем этот синдром может включать и ряд других клинических симптомов, которые наблюдаются достаточно часто, однако в целом не влияют на течение заболевания и тактику ведения больных.
Нарушения деятельности желудочно-кишечного тракта. У 40,5% женщин после ЭМА были отмечены различные нарушения деятельности желудочно-кишечного тракта (ЖКТ). У половины из них, преимущественно у больных с маткой большого размера, превышающего таковой при 14 недельной беременности, отмечалось вздутие живота, парез кишечника, тошнота, однократная рвота. Небольшое преходящее вздутие живота расценивалось как незначительное расстройство функции желудочно-кишечного тракта, присоединение тошноты — как средней степени выраженности, а наличие рвоты и стойкого пареза кишечника — как выраженное нарушение функции. Указанная симптоматика сопровождала ЭМА лишь у тех больных, у которых миома большого размера приводила к нарушению функции соседних органов, особенно кишечника. Поэтому мы считаем, что данные проявления в постэмболизационном периоде являются вполне закономерными и связаны лишь с рефлекторным ответом близлежащих органов на изменения архитектоники матки и ишемические изменения интимно прилежащих к ним миоматозных узлов. Нарушения деятельности сердечно-сосудистой системы. Изменения деятельности сердечно-сосудистой системы (ССС) после ЭМА мы также относим к рефлекторному ответу организма на возникающую острую ишемию органов малого таза и, возможно, сопровождающую болевой и температурный синдром. Следует подчеркнуть, что у подавляющего большинства больных преходящие нарушения деятельности ЖКТ и ССС не сопровождались выраженным негативным влияниям на клиническое состояние пациентов и не требовали проведения специфической терапии. Таким образом, по количеству баллов выраженность симптомов можно разделить на постэмболизационный синдром легкой (до 7 баллов), средней (8-14 баллов) и тяжелой (15-21 балл) степени тяжести. При клинической симптоматике необходимо проведение лечебно-профилактических мероприятий: инфузионная, антибактериальная, обезболивающая, противовоспалительная терапия (5% раствор глюкозы, изотонический раствор хлорида натрия, гемодез, реополиглюкин, метронидазол внутривенно; цефалоспорины третьего поколения внутримышечно, фторхинолоны внутрь; нестероидные противовоспалительные препараты в свечах и таблетках) по показаниям. При легкой степени выраженности синдрома возможно проведение лечебно-профилактических мероприятий с использованием анальгетиков, нестероидных неспецифических противовоспалительных препаратов. При средней степени выраженности необходимо проводить инфузионную (до 800-1200 мл), антибактериальную, противовоспалительную, обезболивающую терапию (используя более сильные препараты: трамал, кеторол), нормализацию функции ЖКТ, органов мочевыделительной системы. При тяжелом постэмболизационном синдроме необходимо назначение наркотических анальгетиков, курса комплексной антибактериальной терапии, противовоспалительной, дезинтоксикационной, инфузионной (1200-2000 мл) терапии, коррекции реологических свойств крови, гемостаза и функции органов ЖКТ и мочевыделительной системы. Проводимая терапия способствует уменьшению выраженности болевого синдрома, интоксикации, в определенной мере предотвращала развитие симптомов раздражения брюшины. После вмешательства быстрое улучшение самочувствия пациентов позволяет им покидать стационар уже на 2-3-и сутки после ЭМА, однако при появлении тревожных клинических симптомов этот срок целесообразно увеличивать до 7-10 дней. Кроме того, в постэмболизационном периоде настоятельно рекомендуется активное амбулаторное обследование больных, перенесших ЭМА, с интервалом 2 недели, затем 1, 2, 3, 6, 12 месяцев, либо постоянно существующую мониторинговую связь "пациент-врач".
Рассматриваемая методика лечения миомы матки является малоинвазивной. После подобной процедуры репродуктивная и менструальная функции сохраняется, что особо важно для молодых женщин. Как и любая другая операция, ЭМА имеет конкретные показания и противопоказания, положительные стороны и недостатки.
Суть эмболизации маточных артерий при лечении миомы матки – для чего выполняется операция?
Рассматриваемую манипуляцию в некоторых медицинских источниках также именуют эмболизацией маточной миомы.
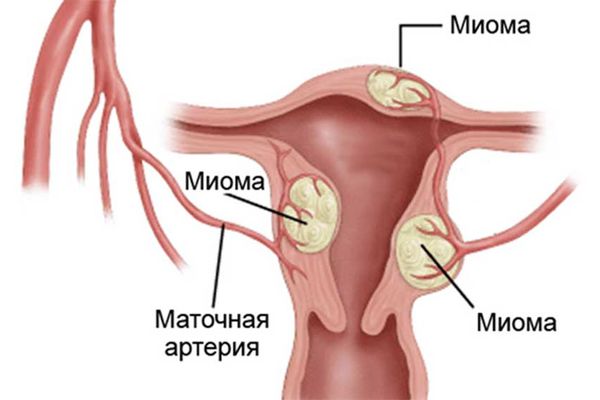
Зачастую отдают предпочтение эмболам, что изготовлены из медицинского пластика. Хотя на практике могут применять частицы из других гипоаллергенных и безопасных для организма материалов.
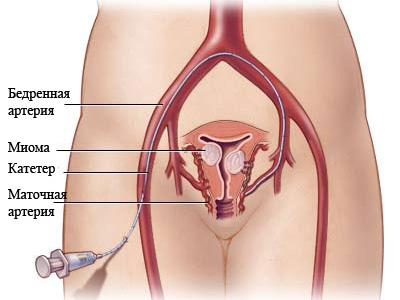
После попадания в кровеносный сосуд указанная частица закупоривает его просвет, перекрывая поступление крови к миоме. Матка при этом сохраняет свою жизнеспособность: ее снабжают артерии яичника, а мышечные компоненты миомы, спустя определенный промежуток времени, заменяются соединительной тканью. Фиброзные образования со временем самоликвидируются.
Видео: Эмболизация маточных артерий (ЭМА) при миоме матки
ЭМА используют независимо от количества патологических узлов и их параметров. Посредством рассматриваемой манипуляции можно значительно сократить размеры миоматозных узлов, а в некоторых случаях — и вовсе от них избавиться.
В крайне редких случаях могут применяться дополнительные лечебные мероприятия.
Вмешательство в репродуктивную систему пациентки в ходе указанной процедуры — минимальное.
Показания и противопоказания к ЭМА
Указанная процедура может назначаться при следующих состояниях:
- Большие параметры матки: как у женщин на 9-й и больше недели беременности.
- Обильные месячные.
- Желание пациентки сохранить жизнеспособность матки.
- Наличие противопоказаний к проведению хирургического вмешательства, а также к гормональной терапии.
- Регулярные боли.
- Сбои в работе органов таза и/или их передавливание.
- Диагностирование множественных/единичных миоматозных узлов, диаметр которых не более 8 см. Если размеры патологических узлов выше, доктор может принять решение о проведении ЭМА как подготовительной манипуляции перед удалением миомы инвазивным методом.
- Бесплодие, спровоцированное миомой матки.
- Период вынашивания ребенка.
- Инфицирование организма.
- Серьезные сбои в работе печени и/или почек.
- Аллергические реакции на йодсодержащие, рентгеноконтрастные вещества.
- Воспалительные явления в зоне половых органов.
- Нарушения, связанные со свертываемостью крови.
- Значительное увеличение объема матки (как у женщин на 20 недели беременности), связанное с гигантским диаметром миоматозных узлов.
- Онкозаболевания матки либо предраковое состояние.
- Кроме того, в случае проведения ЭМА при наличии субсерозных узлов на тонкой ножке существует риск развития перитонита в будущем. Поэтому для лечения подобных новообразований доктор делает выбор в пользу иных методик.
Как проводится эмболизация матки – видео и этапы операции ЭМА
- Тестирование крови на некоторые венерические заболевания.
- Общий анализ крови, мочи, а также кала.
- Проверку группы крови, резус-фактора.
- Флюорографию.
- Электрокардиограмму.
- Развернутый анализ крови.
- Бактериологическое, цитологическое исследование мазков.
- Кольпоскопию.
- Соскоб эндометрия.
- Ангиографию сосудистой сети, что питает матку.
- МРТ. При подозрении на наличие злокачественного новообразования в теле либо шейке матки.
Подготовка к операции:
- За 5 дней до манипуляции пациентке следует пропить антибактериальные средства.
- Женщинам с низким болевым порогом назначают седативные препараты, а в день проведения ЭМА им дают дополнительную дозу обезболивающих.
- В день операции запрещено употреблять какую-либо пищу и жидкость.
- Также нужно побрить зону паха и взять с собой эластичные бинты или компрессионные чулки.
- Минимум за два часа до операции пациентке осуществляют внутривенное вливание антибиотика с целью предотвращения инфицирования организма. Зачастую применяют Цефтриаксон.
Видео: Эмболизация маточных артерий
Алгоритм проведения эмболизации маточных артерий:
- Местное обезболивание.
- Прокалывание правой общей бедренной артерии. Место ее нахождения оперирующий определяет посредством пальпации области паха. Операционную зону обрабатывают обеззараживающим раствором, и в просвет артерии вводят медицинскую иглу под определенным углом.
- Катетеризация артерии. Рентгеноконтрастный катетер с мягким наконечником внедряют при помощи интродьюсера.
- Введение контрастного вещества и выполнение ангиоснимков с целью оценки качества снабжения матки кровью, а также для получения изображения всей сетки кровеносных сосудов, которые обволакивают миому. Пациентка в это время может ощущать дискомфорт (покалывание, тепло) в области матки. Причиной этого является окрашивающее вещество, что продвигается по артериям.
- Непосредственная эмболизация. Для подобных целей шприц с эмболизирующими частицами подсоединяют к катетеру, что обеспечивает поступление микросфер в кровоток. Со временем происходит блокировка просвета необходимых кровеносных сосудов.
- Проведение контрольной ангиограммы и УЗИ-обследование. Если в районе миомы кровоток не наблюдается, доктор извлекает катетер.
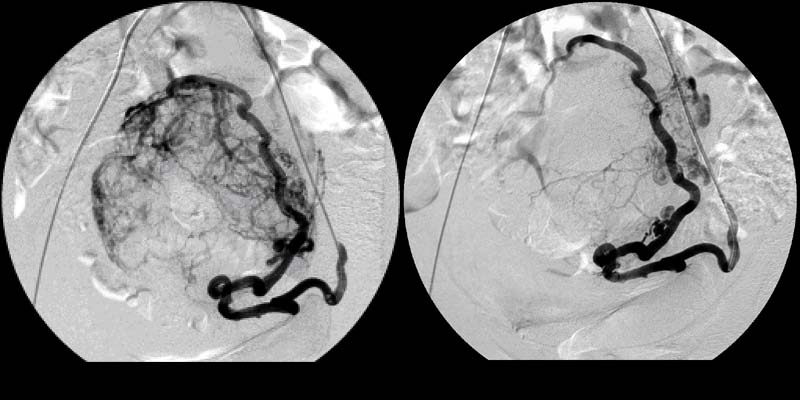
Ангиограммы до и после эмболизации маточной артерии
Результат эмболизации матки – что происходит с миомой?
- В первые несколько часов после операции происходит отмирание мышечных клеток миомы, что сопровождается болевым синдромом.
- Наиболее активное уменьшение патологических узлов наблюдается в первые полгода после рассматриваемой манипуляции.
- Зачастую через год матка приобретает нормальные параметры, а миоматозные узлы сокращаются в 4 раза.
Скорость и природа регрессивных явлений будут определяться параметрами и местом расположения узлов. Если указанные узлы расположены в районе задней стенки матки, уменьшение их размеров будет происходить медленно. При близкой локализации к полости матки узлы на ножке способны отрываться и мигрировать наружу.
Для контроля над процессом трансформации миомы следует проходить ультразвуковое исследование органов малого таза через 3 месяца, полгода и год после эмболизации.
В дальнейшем необходимо каждые 6 месяцев обследоваться у гинеколога с целью исключения рецидива.
Видео: Эмболизация артерий маточной миомы
Восстановление после операции ЭМА и рекомендации пациентам – могут ли быть осложнения?
Первые 8 часов после окончания процедуры пациентке нужен покой. Перевязанную ногу необходимо удерживать в горизонтальном положении, а к месту манипуляции первые пару часов прикладывают пакетик со льдом. Это способствует уменьшению отечности и купированию болевых ощущений.
Пациентке следует носить компрессионное белье на ногах первые несколько дней.
При отсутствии обострений через 1-3 дня разрешается идти домой. Перед выпиской из больницы доктор осуществляет ультразвуковое обследование.
- Незначительное повышение температуры тела.
- Упадок сил.
- Болевые ощущения внизу живота. С целью их устранения назначаются обезболивающие средства.
- Тошнота.
- Рвота. Данный постэмболизационный синдром купируется при помощи противорвотной терапии.
- Кровянистые выделения из влагалища. Менструальный цикл полностью налаживается в течение 3-х месяцев после ЭМА.
Подобные явления могут иметь место от нескольких дней до нескольких недель.
- Посещать сауны, а также длительное время пребывать под прямыми солнечными лучами.
- Проходить любые физиопроцедуры в районе матки.
- Заниматься активными видами спорта.
- Принимать ванны.
- Заниматься вагинальным сексом.
Побочные явления при рассматриваемой процедуре крайне редко — но встречаются.
- Появление гематомы в области прокалывания артерии. Никаких лечебных мероприятий для ее ликвидации не требуется, — она рассасывается самостоятельно.
- Миграция узла в брюшину или матку.
- Эмболизация близлежащих органов в результате попадания эмболов в кровеносные сосуды, что их снабжают. Подобное состояние может развиться на фоне индивидуальных анатомических особенностей.
- Воспалительные процессы в матке, скопление в ее полости гнойных масс. Указанные негативные состояния могут иметь место при обширном отмирании клеток миометрия. В данном случае проводится удаление матки в срочном порядке.
- Пересыхание влагалища, отсутствие сексуального влечения. Случается при закупорке цервиковагинальных сосудов.
Цена эмболизации матки в клиниках России
Стоимость рассматриваемой манипуляции будет определяться несколькими факторами:
- Статусом медицинского учреждения. Сумма за подобную операцию в государственных клиниках зачастую ниже, чем в частных.
- Опытом и авторитетом хирурга.
- Количеством анализов, которые необходимо пройти пациентке. При наличии сопутствующих заболеваний обследование будет более расширенным, а значит и финансовых средств будет потрачено больше.
- Разновидностью медицинских препаратов, которые необходимо пропить либо проколоть перед эмболизацией маточной артерии.
- Объемом окрашивающего вещества для проведения ангиографии.
- Послеоперационными мероприятиями. Сюда входит количество дней, проведенных в стационаре; перечень инструментальных и лабораторных обследований; количество консультаций у доктора.
В среднем, цена за эмболизацию маточных артерий в Московских клиниках будет составлять 110000 рублей.
 Загрузка.
Загрузка.