Содержание:
Сосудов. Ревматизм.
Заболевания сердечно — сосудистой системы. Врожденные пороки сердца и
Врожденные пороки сердца (ВПС) — это аномалии морфологического развития сердца и магистральных сосудов, возникшие в результате нарушения процессов эмбриогенеза.
Этиология. В первые 3 месяца беременности отрицательное влияние на процесс формирования сердца чаще оказывают вирусные инфекции(краснуха, корь, паротит, ветряная оспа,полиомиелит и др.), пороки сердца у матери, экзогенные и эндогенные токсические продукты, ионизирующие радиации, гиповитаминозы, беременность в возрасте старше 35 лет, заболевания половой сферы.
Наиболее принятым является разделение ВПС на «синие» (с цианозом) и «белые» (без цианоза). В зависимости от состояния гемодиализа в малом и большом кругах кровообращения ВПС делятся на 3 группы.
| Нарушения гемодинамики | без цианоза | с цианозом |
| 1 .С обогощением малого круга кровообращения | О АП, ДМПП, ДМЖП | — |
| 2. С обогощением малого круга | изолированный стеноз | Тетрада Фалло |
применением противоастматических средств, нередко вводимых парентерально. При тяжелом течении приступы Удушья частые, длительные, трудно купируются и переходят в астматический статус, при котором приступ, не удается купировать в течение 6-8 часов и более.
Развитие астматического статуса характеризуется нарастанием дыхательной недостаточности, при этом выслушивается большое количество сухих и/или влажных хрипов. Постепенно дыхание становится ослабленным, исчезают хрипы в легких формируется «немое» легкое. При прогрессировании заболевания развивается гипоксемическая кома.
В послеприступном периоде состояние больного постепенно улучшается, но в течение нескольких дней сохраняется влажный кашель с отхождениём светлой слизистой мокроты, могут прослушиваться хрипы.
Диагностика.В общем анализе крови характерна эозинофилия. В мокроте обнаруживают пласты и гранулы эозинофилов, вытесненные из разрушенных клеток (кристаллы Шарко-Лейдена). В крови повышен уровень иммуноглобулинов Е. Для выявления специфического аллергена в межприступный период проводят кожные пробы с аллергенами. При необходимости — провокационные пробы.
Лечение. Влечении бронхиальной астмы выделяют следующие этапы:
• проведение терапевтических мероприятий, направленных на купирование приступа;
3 ) специфическая иммунотерапия.
Для купирования приступа применяют следующие препараты: адреналин, эуфиллин, сальбутамол, изадрин, теофиллин, теофедрин, солутан, беродурап и др. Оказание неотложной помощи при приступе бронхиальной астмы проводят с учетом данных о дозах и сроках ранее применявшихся препаратов, тяжести развившегося приступа. Для купирования легких приступов бронхолитические средства используют в виде ингаляций или внутрь. При среднетяжелом приступе бронхолитики применяют в основном парентерально. В случае их неэффективности подкожно вводят 0,1% раствор адреналина,через 15 минут 5% раствор эфедрина (в возрастной дозировке). Если эффекта нет, переходят к внутривенному введению 2,4% раствора эуфиллина, в тяжелых случаях прибегают к парентеральному введению преднизолона (3-5 мг/кг массы). Проводится оксигенотерапия; показаны антигистаминные средства, транквилизаторы, муколитики и протеолитические ферменты. При выявлении признаков иммунологической недостаточности используют иммуностимулирующие препараты.
| кровообращения | легочной | |
| 3. С обогощением большого круга кровообращения | коарктация аорты | — |
Клиника. При всем разнообразии ВПС можно указать на ряд симптомов общего характера, которые дают возможность заподозрить существенные одной из аномалий. При выраженном нарушении гемодинамики такие дети отстают в физическом развитии. У них довольно часто отмечаются одышка, бледность или цианоз, деформация ногтевых фаланг («часовые стекла», «барабанные палочки»),деформация грудной клетки («сердечный горб»). Расширение градиц сердца, выслушивается систолический шум.
В клиническом течении ВПС (независимо от их вида) отмечают три фазы. Первая фаза — первичной адаптации — ребенок приспосабливается к нарушениям гемодинамики. По мере развития приспособительных защитных механизмов общее состояние улучшается, и больной вступает во вторую фазу — относительной компенсации. Когда будут исчерпаны все резервы защитных приспособительных механизмов, наступает третья — терминальная фаза, для которой характерно расстройство кровообращения, не поддающееся лечению.
Пороки с обогощением малого круга кровообращения
Это пороки, общим анатомическим признаком которых является патологическое сообщение между малым и большим кругами кровообращения со сбросом крови из артериального русла в венозное (левоправый шунт).
Схематическое изображение дефекта: а)открытого артериального протока; б)межпредсердной перегородки; в)межжелудочковой перегородки; 1)аорта; 2)
легочная артерия; 3) Боталлов проток
Открытый артериальный (Боталлов) проток (ОАП) — это один из наиболее часто встречающихся пороков. В нормальных условиях артериальный проток сразу после рождения перестает функционировать и облитерируются в первые 2-3 мес., редко в более поздние сроки. При незаращении протока развивается порок, при котором через отверстие в проток часть крови из аорты сбрасывается в легочную артерию. В результате в большом круге кровообращения поступает недостаточное количество крови, а в малый круг — избыточное.
Четкие клинические признаки обычно появляются на 2-3 году жизни. Характерны одышка, повышенная утомляемость, боли в области сердца. ОМаксимальное давление соответствует норме, минимальное давление низкое, особенно в положении стоя. Пульс скачущий. Перкуторно границы сердца расширены в основном влево и вверх, при развитии легочной гипертензии увеличиваются и правые отделы сердца. Аускультационно — во 2 межреберье слева от грудины систолический шум, который проводится на аорту, шейные сосуды и в межлопатковую область.
Дефект межпредсердной перегородки (ДМПП) является также частой аномалией сердца у детей. Этот ВПС у девочек встречается чаще чем у мальчиков. Отверстие бывает различной величины и в разных частях перегородки вплоть до полного ее отсутствия. Величина дефекта во многом определяет степень гемодинамических расстройств. Кровь через дефект перегородки частично забрасывается из левого предсердия в правое (шунт слева направо).В правой половине сердца повышается систолическое, а затем диастолическое давление, происходит гипертрофия правого предсердия.
Обращает на себя влияние выраженная бледность кожных покровов, иногда расширение и пульсация шейных вен. Примерно у половины детей отставание в физическом развитии. Имеется предрасположенность к респираторным заболеваниям. При аускультации выслушивается систолический шум во 2-3 межреберье слева от грудины.
Дефект межжелудочковой перегородки (ДМЖП) — порок встречается относительно часто. При расположении дефекта в мышечной части перегородки (болезнь Толочинова-Роже) диаметр отверстия небольшой (до 1 см), и гемодина — мические сдвиги не отражаются на состоянии здоровья ребенка. Дефекты в мембранозной части более широкие, и значительная часть крови из левого желудочка сбрасывается в правый. Оба желудочка работают с большой нагрузкой.
Малый дефект в мышечной части межжелудочковой перегородки может не вызывать каких-либо жалоб больного. Однако при обследовании ребенка как бы случайно выявляется грубый скребущий систолический шум с эпицентром в 4-5 межреберье слева от грудины. При высоких дефектах в мембранозной части перегородки у больных отмечается быстрая утомляемость, одышка, периодицески кашель, цианоз, нередко отставание в физическом развитии. Грудная клетка часто деформирована. Верхушечный толчок высокий, разлитой, смещенный вниз. Перкуторно — границы сердца расширены в поперечнике и вверх. При
аускультации слева от грудины выслушивается систолический шум, который проводится во всех направлениях и на спину.
Пороки с обогощением малого круга кровообращения Изолированный стеноз легочной артерии. Имеются различные анатомические варианты этого порока, наиболее распространенным является клапанный стеноз легочной артерии.
Схематическое изображение изолированного стеноза легочной артерии.
При этот пороке затруднен переход крови из правого желудочка в левую артерию и наблюдается обеднение малого круга кровообращения. Клинически имеют место жалобы на быструю утомляемость и боли в области сердца, одышку, обращает на себя
внимание бледность. При перкуссии определяется расширение границ сердца преимущественно вправо. Во 2 межреберье слева от грудины выслушивается грубый систолический шум, который проводится в левую подключичную область и на сонные артерии. 1 тон на верхушке-усилен,2 тон на легочной артерии ослаблен или отсутствует.
Болезнь Фалло (триада, тетрада, пентада). Наиболее распространенной формой «синих» пороков сердца, протекающих с цианозом, является тетрада Фалло. Порок включает сочетание четырех аномалий:
1 )стеноз легочной артерии;
• дефект межжелудочковой перегородки;
• транспозиция аорты вправо;
• гипертрофия правого желудочка.
Малый круг кровообращения недостаточно обеспечивается кровью. В большой круг через аорту, «сидящую верхом» над дефектом в межжелудочковой перегородке, поступает смешанная кровь — артериальная из левого и венозная из правого желудочка. В связи с сужением легочной артерии и повышенным давлением в аорте правый желудочек гипертрофируется.
Цианоз, иногда заметный сразу после рождения, с возрастом усиливается. Одышка у грудных детей появляется при небольшой физической нагрузке, при кормлении. Нередко приступы цианоза с потерей сознания, судорогами у грудных детей. У детей старшего возраста чаще отмечаются более легкие приступы, во время которых ребенок принимает вынужденное положение — присаживается на корочки или ложится ничком. Дети жалуются на головные боли, головокружение, обмороки. Как правило, имеют место отставание в физическом развитии, деформация пальцев («барабанные палочки»).
Симптом «присаживания на корточки» при тетраде Фалло
«Барабанные» палочки при врожденном пороке сердца
При аускультации во 2 и 3 межреберье выслушивается грубый продолжительный систолический шум, 2 тон в области легочной артерии ослаблен. В периферической крови повышается уровень гемоглобина и количество эритроцитов («сгущение» крови).
Пороки с обогощением большого круга кровообращения Каорктация аорты — сужение грудного отдела аорты ниже уровня устья левой подключичной артерии. Схематическое изображение каорктации аорты
Степень и протяженность сужения может быть различной. Сосуды нижней половины тела получают мало крови. Выше места сужения наблюдается гипертензия, распространяющаяся на сосуды головы, плечевого пояса, верхних конечностей. Жалобы появляются поздно и связаны с синдромом гипертонии и декомпенсацией сердечной деятельности. Больные жалуются на головную боль, головокружения, шум в ушах, одышку, утомляемость. При осмотре бросается в глаза лучшее развитие верхней половины туловища в сравнении с нижней. Отмечаются ишемические боли в животе и икроножных мышцах.
Одним из основных клинических симптомов является разница в показателях АД на верхних и нижних конечностях.
Измерение АД на ноге
Измерение АД на руке
Характерно высокое артериальное давление (до 250-300 мм.рт.ст) на верхних конечностях, и одновременное снижение его (иногда до нуля) на нижних. Пульс на нижних конечностях слабый, на верхних — напряженный. Перкуторно — границы сердца расширены влево. Аускультативно — акцент 2 тона над аортой, иногда нехарактерный систолический шум на основанием сердца или в межлопаточковом пространстве. Схематическое изображение каорктации аорты
Степень и протяженность сужения может быть различной. Сосуды нижней половины тела получают мало крови. Выше места сужения наблюдается гипертензия, распространяющаяся на сосуды головы, плечевого пояса, верхних конечностей. Жалобы появляются поздно и связаны с синдромом гипертонии и декомпенсацией сердечной деятельности. Больные жалуются на головную боль, головокружения, шум в ушах, одышку, утомляемость. При осмотре бросается в глаза лучшее развитие верхней половины туловища в сравнении с нижней. Отмечаются ишемические боли в животе и икроножных мышцах.
Одним из основных клинических симптомов является разница в показателях АД на верхних и нижних конечностях.
Измерение АД на ноге
Измерение АД на руке
Характерно высокое артериальное давление (до 250-300 мм.рт.ст) на верхних конечностях, и одновременное снижение его (иногда до нуля) на нижних. Пульс на нижних конечностях слабый, на верхних — напряженный. Перкуторно — границы сердца расширены влево. Аускультативно — акцент 2 тона над аортой, иногда нехарактерный систолический шум на основанием сердца или в межлопаточковом пространстве. Клиника. Клинические проявления ревматизма разнообразны и зависят от локализации ревматического процесса и степени его активности.
В типичных случаях заболевание развивается через 2-3 недели, после перенесенной стрептококковой инфекции, и характеризуется подъемом температуры, появлением симптомов интоксикации, одышки, тахикардии, кружевной рисунок. В течение дня кольцевидная эритема может несколько раз исчезать и вновь появляться.
Ревматические узелки в настоящее время встречаются редко, могут быть различной величины, локализуются в области крупных суставов, по ходу сухожилий, исчезают медленно, следов не оставляют.
Особенностью течения ревматизма у детей является вовлечениев патологический процесс нервной системы в виде малой хореи. Заболевание начинается постепенно, с появления эмоциональной
неустойчивости(раздражительности, плаксивости), общей слабости, двигательного беспокойства. Типичная клиническая картина хореи развивается через 2-3 недели после начала заболевания:
1 )гиперкинезы (непроизвольные порывистые движения различных мышечных групп, усиливающиеся при эмоциях, воздействии внешних раздражителей и исчезающие во сне);
• нарушения координации движений ;
• нарушения эмоциональной сферы.
Изменяется поведение ребенка, появляются гримасничанье, ниряшливость, меняется почерк. Выздоровление Почерк при хорее 2-го класса
Движения при малой хорее неритмичные, разбросаны по всему телу, совершаются в быстром темпе. При выраженных гиперкинезах мышц гортани нарушается глотание и речь.
Малая хорея приводит, как правило, с умеренным поражением сердца, нормальной температурой тела и незначительными изменениями лабораторных показателей. В настоящее время чаще наблюдаются стертые формы хореи, когда отмечаются только отдельные слабовыраженные признаки поражения нервной системы.
Малая хорея продолжается обычно 2-3 месяца (реже 6-12 месяцев). Очень характерно появление рецидивов. Однако к 17-18 годам она почти всегда исчезает.
Течение ревматизма имеет 2 фазы — активную и неактивную. К активной фазе относят все проявления текущего процесса по данным клинического и лабораторно-инструментального обследования. Неактивная фаза включает остаточные явления (порок сердца, миокардиосклероз и др.) при отсутствии показателей активности.
В качестве диагностических признаков активного ревматизма используются крмтерии Киселя- Джонсона- Нестерона, согласно которым основными являются кардии, полиартрит, хорея, ревматические узелки, аннулярная эритема, ревматический анамнез. относятся лихорадка, артралгии, лабораторные изменения, изменения ЭКГ, эффективность антиревматического лечения.
Различают 3 степени активности процесса: 1 — минимальная, 2- умеренная,3 — максимальная.
При 3 степени активности симптомы ярко выражены, высокая температура, на ЭКГ четкие признаки кардита, изменены лабораторные показатели.
2 степеть активности характеризуется умеренно выраженными клиническими, лабораторными и другими признаками заболевания. Лихорадка может отсутствовать.
При 1 степени активности клинические, лабораторные и инструментальные признаками ревматизма слабо выражены.
Выделяют острое (до 2 мес), подострое (доЗ-4 мес), затяжное (до5 мес), рецидивирующее (1 год и более),латентное (клинически бессимптомное) течение активной фазы.
Диагностика. Лабораторные методы используют в основном для определения активности патологического процесса и наблюдения за эффективностью лечения. В общем анализе крови отмечается лейкоцитоз, сдвиг формулы влево, повышенная СОЭ, возможна эозинофилия.
При биохимическом исследовании выявляются диспротеинемия, С-реактивный белок, повышенное содержание фибриногена, отмечается нарастание титров противострептококковых антител: антистрептолизина О (АСЛ-О), антистрептогиалуронидазы (АСГ), антистрептокиназы (АСК).
Лечение ревматизма должно быть этапным, комплексным и длительным. Востром периоде дети должны находиться в стационаре. Длительный режим должен быть индивидуальным, показано временное ограничение физической активности. Больные со 2-3 степенью активности должны находиться 1-2 недели на строгом постельном режиме, а затем еще 2-3 недели на постельном режиме. Спустя 1-1,5 мес. С учетом результатов функциональных проб детей переводят на тренирующий режим. В последующем в санатории (2 этап) дети переводятся на тренирующий режим. Показано раннее назначение ЛФК по специально разработанным комплексам. Диета должна быть легкоусвояемой, обогащенной белком, витаминами, продуктами, содержащими калий. Ограничиваются соль и жидкость, экстрактивные вещества (стол №10).
Медикаментозная терапия ревматизма направлена на:
Борьба со стрептококковой инфекцией;
Подавление воспаления соединительной ткани;
Уменьшение сенсибилизации организма.К дополнительным диагностическим критериям В связи с этим основными лекарственными средствами лечения ревматизма является: бензилпенициллина натриевая соль (10-14 дней), затем переходят на «Бициллин-5» или «Бициллин-1»; салицилаты или производные пирозолона (анальгин) или нестероидные противовоспалительных(индометацин,вольтарен), в течение 4 недель — полная доза, затем 2 недели половинная доза. Преднизолон назначают в постепенно уменьшающихся дозах.
Десенсибилизирующие средства: супрастин, тавегил, пипольфен,диазолин, и др. Крове основных, базисных препаратов,назназают поливитамины,препараты калия (панангиноротат калия), сердечные кликогены.
При хорее назначают весь комплекс антиревматического лечения с дополнительным включением бромидов, малых транквилизаторов (элениум, триоксазин).
Показано физиотерапевтическое лечение,
Долечивание и реабилитация больных (3 этап) осуществляются в местном санатории в течение 2-3 месяцев.
Дальнейшее диспансерное наблюдение (4 этап) осуществляется в поликлинике ревматологом, который регулярно осматривает каждого ребенка, страдающего ревматизмом, с целью выявления признаков активации болезни, проводит вторичную круглогодичную профилактику рецидивов с помощью «Бициллин- 5».При необходимости санируют очаги хронической инфекции, определяют условия режима и труда школьников. Диспансерное наблюдение за детьми, перенесшими ревматизм, проводится вплоть до передачи их для наблюдения в подростковом кабинете.
Профилактика. Первичная профилактика направлена на предупреждения возникновения ревматизма, вторичная — на предупреждение прогрессирования заболевания и возникновения рецидивов заболевания. Проводится круглогодичная бициллинопрофилактика не менее 3 лет при отсутствии рецидивов. В последующие 2 года проводится только сезонная профилактика (осенью и весной) с одновременным назначением «Бициллин-5», ацетилсалициловой кислоты и витаминов. В активной фазе заболевания показано санаторно-курортное лечение: Кисловодск, Сочи, Мацеста, Цхалтубо, Липецк.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8547 —  | 7049 —
| 7049 —  или читать все.
или читать все.

Пороки развития представляют собой патологическое отклонение от нормального строения организма. Наиболее часто порок возникает вследствие нарушения внутриутробной закладки органов и систем, однако может формироваться и после рождения.
Врожденные пороки развития занимают одну из лидирующих позиций среди всех заболеваний, которые могут приводить к летальному исходу. Они разделяются на три большие группы: легко корригируемые, несовместимые с жизнью и совместимые с жизни, но снижающие ее качество.
Пороки развития могут возникать в любой части детского организма. Это говорит о том, что от такого патологического процесса могут страдать не только внутренние органы, но и внешний вид ребенка. В качестве примера можно привести заячью губу, недоразвитие конечностей и так далее.
Существует большое количество разнообразных факторов риска, которые существенно повышают вероятность формирования врожденного порока развития. В первую очередь — это различные инфекционные заболевания, перенесенные женщиной во время беременности, например, ветряная оспа или краснуха. Кроме этого, огромную роль в развитии такой патологии играют вредные привычки беременной женщины. Если в момент вынашивания ребенка она употребляла наркотики или алкоголь, вероятность возникновения данного патологического процесса возрастает во много раз. К другим факторам риска относятся:
- Генетическая предрасположенность;
- Недостаточное поступление кислорода к плоду;
- Воздействие химических веществ, например, некоторых лекарственных препаратов;
- Влияние неблагоприятных факторов окружающей среды на организм беременной женщины;
- Травмирующие механические воздействия на плод или женский организм;
- Различные эндокринные заболевания.
Очень часто пороки развития возникают в области сердечно-сосудистой системы. При этом в большинстве случаев такой патологический процесс имеет тяжелое течение и значительное ухудшает качество жизни больного малыша.
Симптомы врожденных пороков развития

Врожденные пороки развития сердечно-сосудистой системы могут быть представлены различными нарушениями со стороны сердечных перегородок, клапанов или отходящих от сердца сосудов. При этом они могут приводить к обеднению малого или большого кругов кровообращения или к увеличению кровотока в них. В некоторых случаях кровоток остается не измененным. Рассмотрим наиболее часто встречающиеся нарушения:
- Дефект межжелудочковой перегородки
Такая патология характеризуется образованием в перегородке, находящейся между правым и левым желудочками, патологического отверстия. Через это отверстие происходит аномальный сброс крови, приводящий к перегрузке и гипертрофическим изменениям в желудочках. Клиническая форма данного порока развития напрямую зависит от размера возникшего дефекта. В том случае, если дефект имеет небольшие размеры, отмечаются повышенная утомляемость и частая одышка, возникающая при физической нагрузке. Однако ребенок, как правило, не отстает в своем физическом развитии от сверстников. Большое патологическое отверстие приводит к тому, что приступы одышки развиваются даже в состоянии покоя. Малыш становится бледным, вялым и медленно набирает массу тела. Такой патологический процесс сопровождается частыми заболеваниями со стороны бронхолегочной системы и по мере своего прогрессирования приводит к формированию сердечной недостаточности;
- Дефект межпредсердной перегородки
В этом случае в перегородке, находящейся между правым и левым предсердиями, возникает аномальное отверстие. Оно вызывает патологический сброс крови, сопровождающийся перенаполнением малого круга кровообращения и повышающий нагрузку на правые отделы сердца. Клиническая картина данного заболевания сопровождается появлением бледной окраски кожных покровов, одышки при физической нагрузке и цианозом носогубного треугольника. Малыш отстает в физическом развитии и часто страдает от респираторных заболеваний. По мере его взросления присоединяются такие признаки, как частые головокружения и обморочные состояния. Со стороны сердечного ритма могут отмечаться тахикардия и аритмия;
Это такой патологический процесс, при котором происходит сужение аортального отверстия и затруднение выхода крови из полости левого желудочка. Вследствие этого левый желудочек подвергается гипертрофическим изменениям. Ребенок предъявляет жалобы на ощущение сердцебиения, частые одышки и повышенную слабость. По мере прогрессирования заболевания отмечаются периодические головокружения, потери сознания. В тяжелых случаях может развиваться сердечная астма;
- Стеноз устья легочной артерии
Характеризуется сужением в месте перехода из правого желудочка в легочную артерию. В результате этого правый желудочек не может полноценно выбрасывать из себя кровь и подвергается перегрузке. Симптоматика такой патологии схожа с вышеописанными процессами. Отмечаются частые одышки, головокружения и повышенная слабость. Малыш медленно набирает массу тела и часто страдает от воспалительных заболеваний дыхательной системы. Кожные покровы становятся бледными, появляется цианоз.
Диагностика пороков развития
Для диагностики пороков развития сердца могут использоваться следующие инструментальные методы:
- Электрокардиографическое исследование;
- Эхокадиография и фонокардиография;
- Рентгенография и вентрикулография;
- Зондирование сердечных полостей.
Лечение ребенка и профилактика таких патологий

В том случае, если порок развития имеет небольшие размеры и не доставляет каких-либо значительных беспокойств, рекомендуется динамическое наблюдение за таким больным. Однако, если происходит выраженное нарушение общего состояния, проводится хирургическое вмешательство. Его методы и объемы подбираются индивидуально в зависимости от локализации патологического процесса и степени его выраженности.
Для профилактики вышеперечисленных патологий необходимо максимально ограничивать все вредные воздействия на организм беременной женщины.
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.


Читайте в новом номере
НЦССХ имени А.Н. Бакулева РАМН, Москва
В рожденные пороки сердца (ВПС) — достаточно распространенная патология среди заболеваний сердечно-сосудистой системы, которая является основной причиной смерти детей первого года жизни. Частота ВПС составляет 30% от всех пороков развития. Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих уcловиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Основными причинами рождения детей с ВПС являются: хромосомные нарушения — 5%; мутация 1-го гена — 2–3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) — 1–2% ;полигенно-мультифокальное наследование — 90%.
Помимо этиологических выделяют факторы риска рождения ребенка с ВПС. К ним относятся: возраст матери, эндокринные заболевания супругов, токсикоз и угроза прерывания I триместра беременности, мертворожденные в анамнезе, наличие детей с врожденными пороками развития у ближайших родственников. Количественно оценить риск рождения ребенка с ВПС в семье может только генетик, но дать предварительный прогноз и направить родителей на медико-биологическую консультацию может каждый врач.
Встречается более 90 вариантов ВПС и множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР была разработана классификация, основанная на распределении ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
Для практикующих врачей-кардиологов удобнее пользоваться более упрощенным делением ВПС на 3 группы:
1. ВПС бледного типа с артериовенозным шунтом: дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый атриовентрикулярный канал (АВК).
2. ВПС синего типа с веноартериальным шунтом: транспозиция магистральных сосудов (ТМС), тетрада Фалло (ТФ), триада Фалло, атрезия трикуспидального клапана (АТК) и т.д.
3. ВПС без сброса, но с препятствием на пути кровотока из желудочков (стенозы легочной артерии и аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при врожденных пороках сердца
Не случайно во всех предложенных классификациях большое внимание уделено оценке нарушений гемодинамики при ВПС, так как степень этих нарушений тесно связана с анатомической тяжестью порока, от них зависит тактика медикаментозного лечения и сроки выполнения операции.
ВПС вызывает ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в организме больного с ВПС наблюдаются следующие патологические изменения:
• при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока в легких (пороки синего типа с веноартериальным шунтом) у больного развивается гипоксемия;
• при увеличении кровотока в малом круге кровообращения развивается гиперволемия и легочная гипертензия.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких. Существует много классификаций легочной гипертензии. Для практики наиболее удобной является классификация, разработанная в ИССХ им. А. Н. Бакулева АМН СССР (В.И. Бураковский и соавт., 1975). Она основана на величине давления в легочной артерии, степени сброса крови и соотношении общелегочного сопротивления к показателям большого круга кровообращения (табл. 1).
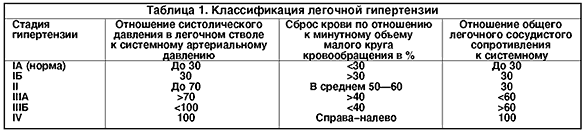
Согласно этой классификации, больные делятся на 4 группы, где I и III стадия разделены на подгруппы А и Б. Больные IА группы имеют небольшие нарушения гемодинамики и нуждаются в наблюдении кардиолога. У больных IБ и II группы ставится вопрос об операции. Легочная гипертензия в этих группах носит функциональный характер.
У больных III группы при большом сбросе крови в малый круг изменения в легочных сосудах значительно более выражены. При IIIА гемодинамической группе возможна радикальная коррекция порока, и давление после операции снижается. В IIIБ и IV группе хирургическое лечение не показано. Дифференциальный диагноз между IIIА и Б группами сложен, и нередко для решения вопроса об операбельности порока необходимо выполнить внутрисосудистое ультразвуковое исследование и/или биопсию легкого для изучения морфологических изменений в легочных сосудах. Для оценки этих изменений наиболее часто используется классификация, предложенная Д. Хитом и Дж. Эдвардсом в 1958 г. (табл. 2).

При цианотических формах ВПС наличие сброса венозной крови в артериальную или смешение крови ведут к увеличению объема крови в большом круге кровообращения и уменьшению в малом, что приводит к снижению насыщения крови кислородом (гипоксемии) и к появлению цианоза кожи и слизистых. Для улучшения доставки кислорода к органам и повышения эффективности вентиляции происходит развитие коллатерального кровообращения между сосудами большого и малого круга кровообращения. Перестройка коллатеральной сети кровообращения происходит в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и головного мозга.
Благодаря компенсаторным механизмам состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения гемодинамики, может быть длительно удовлетворительным, но постепенно компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому оперативное вмешательство при цианотических пороках (радикальное или паллиативное) показано в самом раннем детском возрасте.
Первичная диагностика ВПС основывается на данных неинвазивных методов исследования. Большое значение для диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. При бледных пороках сердца необходимо выяснить, часто ли болеет ребенок респираторными инфекциями, были ли у него пневмонии, так как это говорит о большом сбросе крови слева-направо. С другой стороны, прекращение респираторных инфекций у больного с большим сбросом крови в малый круг говорит о начале развития легочной гипертензии. Это должно быть поводом для направления больного к кардиохирургу. Естественное течение ВПС может осложниться развитием инфекционного эндокардита, поэтому необходимо выяснить, бывают ли у ребенка подъемы температуры тела без признаков респираторной инфекции. Следует также выяснить, не было ли у больного синкопальных состояний, судорожного синдрома, которые могут быть следствием аритмий сердца.
При осмотре ребенка с подозрением на ВПС необходимо отметить цвет кожных покровов и слизистых. Цианоз может быть периферическим и генерализованным. Важно отметить наличие или отсутствие цианоза на всех 4 конечностях, так как при некоторых ВПС наблюдается дифференцированный цианоз (предуктальная коарктация аорты, транспозиции магистральных сосудов в сочетании с перерывом дуги аорты). При осмотре грудной клетки необходимо отметить деформацию грудной клетки в области сердца — появление так называемого сердечного горба (по величине и локализации которого можно косвенно судить о сложности ВПС и/или развитии легочной гипертензии).
При пальпации грудной клетки у больного с ВПС можно отметить смещение верхушечного толчка, изменение его площади, наличие “дрожания” над областью сердца. Пальпация позволяет оценить размеры печени и селезенки. Методом перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее информативным методом физикального обследования больных с ВПС. При аускультации можно отметить изменение тонов сердца (усиление, ослабление или расщепление), появление шумов, а также их локализацию, иррадиацию и место максимального выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока, например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной артерии эта зависимость носит обратный характер. При аускультации легких можно выявмть признаки застоя в малом круге.
Физикальное исследование дополняется проведением неинвазивного инструментального обследования, которое включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ) и рентгенографию органов грудной клетки.
ЭКГ позволяет судить о гипертрофии различных отделов сердца, патологических отклонениях электрической оси, наличии нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для какого-либо порока, но в сочетании с данными, полученными при клиническом обследовании и с помощью других неинвазивных методов, позволяют судить о тяжести порока. Разновидностью метода ЭКГ является холтеровское суточное ЭКГ-мониторирование, которое помогает выявить скрытые нарушения ритма и проводимости.
Следующим неинвазивным методом обследования кардиологических больных является ФКГ, которая воспроизводит данные аускультации сердца и позволяет более детально и количественно оценить характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография органов грудной клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга кровообращения (наличие артериального или венозного застоя, снижение наполнения сосудов легких); расположение, форму, размеры сердца и его отдельных камер; изменения со стороны других органов и систем (легкие, плевра, позвоночник, а также расположение внутренних органов).
Сочетание ЭКГ, ФКГ и рентгенография органов грудной клетки позволяет диагностировать большинство изолированных пороков и предположить наличие сложных ВПС.
Наиболее высокоинформативным неинвазивным методом исследования является эхокардиография (ЭХОКГ). С появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились возможности диагностики ВПС. Этот метод позволяет провести анатомически точную диагностику дефектов перегородок сердца, поражения атриовентрикулярных и полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов, а также оценить сократительную способность миокарда. При определенных пороках (неосложненные ДМПП, ДМЖП, ОАП, частично открытый АВК, коарктация аорты) можно выполнить операцию без проведения катетеризации сердца. Однако в ряде случаев при сложных ВПС и сопутствующей легочной гипертензии необходимо провести катетеризацию сердца и ангиокардиографию, так как эти методы позволяют провести точную анатомическую и гемодинамическую диагностику ВПС. Проведение катетеризации сердца возможно только в условиях специализированной кардиохирургической клиники. В настоящее время при проведении катетеризации сердца в случае необходимости выполняется электрофизиологическое исследование для уточнения механизма аритмий сердца, оценки функции синусового и атриовентрикулярного узлов, а также проводятся различные эндоваскулярные операции: баллонная ангиопластика при стенозах легочной артерии и аорты; эмболизация небольших ОАП, коронаросердечных фистул, аортолегочных коллатералей; баллонная атриосептостомия при простой ТМС и стентирование легочных сосудов при периферических стенозах.
Тактика хирургического лечения
Тактика оказания помощи больным с ВПС строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. После установления диагноза необходимо решить:
1. Как лечить больного (медикаментозно или хирургически)?
2. Определить сроки выполнения операции.
Ответить на эти вопросы помогает классификация, предложенная J. Kirklin и соавт. (1984).
0-я группа – больные с ВПС, с незначительными нарушениями гемодинамики, которые не нуждаются в операции.
1-я группа – больные, состояние которых позволяет провести операцию в плановом порядке ( через год и более).
2-я группа – больные, которым операция показана в ближайшие 3–6 мес.
3-я группа – больные с тяжелыми проявлениями ВПС, которых необходимо оперировать в течение нескольких недель.
4-я группа – больные, нуждающиеся в экстренной операции (в течение 48 ч после госпитализации).
Наиболее сложная проблема в кардиохирургии – операция у детей первого года жизни с ВПС. Хирургическая летальность в последние годы значительно снижена и отличается от высокой естественной смертности при ВПС. Операция у детей первого года жизни выполняется в том случае, если консервативными методами не удается достичь стабилизации состояния. Большинство неотложных операций выполняются у детей с цианотическими ВПС.
Если у новорожденного с ВПС отсутствуют признаки сердечной недостаточности, цианоз выражен умеренно, то консультация кардиохирурга может быть проведена позднее. Наблюдение за такими детьми осуществляет кардиолог по месту жительства. Такая тактика позволяет провести обследование больного в более благоприятных условиях, снизить риск проведения инвазивных методов исследования и оперативного вмешательства.
В более поздней возрастной группе хирургическая тактика при ВПС зависит от тяжести патологии, предполагаемого прогноза, возраста и массы тела больного. K.Turley и соавт. в 1980 г. предложили разделить ВПС на 3 группы, в зависимости от вида возможной операции.
К 1-й группе относятся такие наиболее часто встречающиеся пороки, как ОАП, ДМЖП, ДМПП, частично открытый АВК, коарктация аорты, стеноз и недостаточность митрального и аортального клапанов. При установлении данных пороков единственным выбором может быть операция. Она может быть отложена, если нарушения гемодинамики нерезко выражены, а возраст ребенка и масса тела слишком малы (более поздний возраст и достаточная масса тела снижают риск выполнения кардиохирургических вмешательств).
Во 2-ю группу входят сложные цианотические пороки, такие, как тетрада Фалло, стеноз легочной артерии, атрезия легочной артерии 1-го типа, транспозиция магистральных сосудов и др. Выбор между радикальной и паллиативной операцией зависит от анатомической тяжести порока, степени гипоксемии и массы тела ребенка.
К 3-й группе относятся ВПС, при которых возможна только паллиативная или гемодинамическая коррекция порока. К ней относятся различные варианты сложных пороков: атрезия трикуспидального и митрального клапанов, двухкамерное сердце, синдром гипоплазии правого и левого сердца, единственный желудочек сердца и др.
Радикальная коррекция простых неосложненных пороков не представляет технических трудностей для специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется ушивание или пластика дефектов заплатой, при ОАП — перевязка или пересечение протока. При выраженной гипоксемии первым этапом у больного с ВПС проводится паллиативная операция — наложение различных межсистемных анастомозов. После проведения операции улучшается насыщение крови кислородом, что позволяет ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных операций, по данным различных авторов, не только не увеличивает риск вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия трикуспидального и митрального клапанов, единственный желудочек сердца, двухкамерное сердце и т.д.) выполнение радикальной операции не представляется возможным и единственной операцией может быть гемодинамическая коррекция внутрисердечной гемодинамики, которая позволяет разделить артериальные и венозные потоки крови, не устраняя полностью анатомические пороки. К ним относятся различные модификации гемодинамической коррекции по методу Фонтена, Мастарда и Сенинга.
Список литературы Вы можете найти на сайте http://www.rmj.ru
1. Бураковский В.И., Бухарин В.А. Константинов С.А. и др. Врожденные пороки сердца. В кн. Частная хирургия болезней сердца и сосудов / Под ред. В.И. Бураковского и С.А.Колесникова. М.: Медицина, 1967; 315—23.
2. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М. Медицина, 1975; 247.
3. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983; 33—96.
4. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. — М. Медицина, 1987; 918.
5. Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия / Под ред. В.И. Бураковского, Л.А. Бокерия. М. Медицина, 1989; 345—82.
6. Иваницкий А.В., Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985; 8 (7) 55—7.
7. Н.А.Белоконь, В.П. Подзолков. Врожденные пороки сердца. М. Медицина, 1991; 352.