Содержание:
Острый инфекционный эндокардит может протекать по типу бактериального шока или сепсиса. В этих случаях поражение эндокарда может быть обнаружено лишь на аутопсии.
При подострых формах инфекционный эндокардит из-за скудности клинических проявлений диагноз может быть поставлен лишь спустя неделю или месяцы от начала заболевания. Наличие у ребенка врожденного порока сердца также затрудняет постановку диагноза из-за трудности обнаружения изменения характера аускультативной картины и часто неправильной трактовки субфебрилитета, связываемого с гипоксией ЦНС. Несмотря на многообразие клинических проявлений инфекционного эндокардита, можно выделить четыре наиболее важных клинических синдрома:
• инфекционное поражение клапанов и структур сердца;
• тромбоэмболические осложнения;
• бактериемия с метастазированием инфекции;
• иммунопатологические реакции.
Лихорадка
Наиболее частым проявлением инфекционного эндокардита является лихорадка.
Повышение температуры тела отсутствует только в 10% случаев. Гипертермия служит неспецифическим проявлением воспаления.
При остром течении заболевания лихорадка может иметь гектический размах с самостоятельным снижением температуры тела в вечерние и ночные часы, сопровождающимся обильным потоотделением. При подострых формах заболевания температура тела имеет обычно невысокие значения.
Симптомы хронической интоксикации
Симптомы хронической интоксикации определяются у большинства детей и проявляются недомоганием, анорексией, похудением, повышенной утомляемостью, нарушением сна, ригидностью шейных мышц, рвотой, тошнотой, болями в животе и головной болью. Тошнота, рвота и боли в животе встречаются в 16% случаев, обычно связаны с интоксикацией, но могут быть проявлением тромбоэмболии в мезентериальных сосудах.
Симптомы, связанные с бактериемией и иммунопатологическими реакциями
К этим симптомам можно отнести появление сыпи, миалгий и артралгий. Поражение крупных суставов с артралгией или артритом отмечается у 24% пациентов. Увеличение селезенки наблюдается у 55% детей с ИЭ. Этот симптом чаще отмечается при подостром течении заболевания и активации иммунной системы. При пальпации селезенка, как правило, безболезненна. Инфаркт или абсцесс селезенки должны быть заподозрены при появлении болей в верхнем левом квадранте живота с иррадиацией в область плеча.
Иногда обнаруживают узелки Ослера. Они представляют собой красноватого цвета болезненные очаги уплотнения в коже и подкожной клетчатке, являющиеся воспалительными инфильтратами в результате поражения мелких сосудов, встречаются в 7-8% случаев. Расположены обычно на ладонной поверхности кончиков пальцев рук, в области тенара и гипотенара, а также на подошвенной поверхности I пальца стоп. Узелки Ослера рассматривают либо как септическую эмболию, либо как иммунокомплексный васкулит. Проявлениями иммунопатологических реакций могут быть субконъюнктивальные кровоизлияния, петехии, пятна Джейнуэя (7% случаев). Пятна Джейнуэя представляют собой красные пятна или болезненные экхимозы на подошвах и ладонях. Они являются результатом септической эмболии с последующим развитием некроза и подкожного кровоизлияния.
Симптомы, связанные с поражением сердца
Наиболее важным диагностическим симптомом инфекционного эндокардита является усиление или появление нового шума.
Боли в области грудной клетки встречаются в 10% случаев, чаще при правостороннем ИЭ, могут быть результатом миалгий, но иногда бывают проявлением эмболии легочных сосудов при правосторонних ИЭ.
Появление одышки свидетельствует о прогрессировании сердечной недостаточности.
Симптомы, обусловленные тромбоэмболией
Системная или легочная эмболизация обусловлена соответственно левоили правосторонней локализацией бактериальных вегетаций.
Левосторонние симптомы эмболизации проявляются инфарктами или висцеральными кровоизлияниями. Эмболы центральной нервной системы обусловливают транзиторные ишемические нарушения кровообращения и инсульты. Поражение ЦНС в виде гемипареза, эпилептических судорог, атаксии, афазии, очаговой неврологической симптоматики, потери чувствительности, изменения психического статуса может сохраниться в течение длительного времени после выздоровления от ИЭ. Поражение глазной артерии может привести к потере зрения.
Системная тромбоэмболия (митральный и аортальный клапаны) может вызвать окклюзию любой артерии, включая коронарные артерии, аорту, почечные, висцеральные или периферические артерии. Возникает инфаркт или ишемия соответствующего органа.
Правосторонние вегетации (трикуспидальный клапан и клапан легочной артерии) обусловливают эмболию легочной артерии и инфаркт легких. Множественные, повторные микроэмболы могут приводить к легочной гипертензии или легочному сердцу.
Частота тромбоэмболических осложнений, обнаруживаемых на аутопсии, выше, чем количество случаев, выявляемых клинически. Клинические проявления тромбоэмболии определяются у 5-30% пациентов, зависят от места локализации.
Другие признаки и симптомы инфекционного эндокардита
Застойная сердечная недостаточность возникает у 30% детей, чаще на фоне первичного поражения сердца. Может сопровождаться выпотным плевритом. Причиной гепатомегалии обычно является недостаточность кровообращения, однако она может быть обусловлена токсическим гепатитом, аутоиммунным поражением печени.
Неврологическая симптоматика встречается в 20% случаев ИЭ у детей. Часто внезапное начало заболевания с клинической картиной нарушения мозгового кровообращения является первым проявлением ИЭ, что может затруднить постановку диагноза и проведение адекватной терапии.
Поражение почек при ИЭ бывает следствием микроэмболии с последующим развитием микроинфаркта, обнаруживаемого в 56% аутопсий, или результатом гиперкомплементемии при подостром или хроническом течении заболевания с последующим развитием иммунокомплексного гломерулонефрита, возникающего у 10-15% пациентов. Нередко первыми проявлениями ИЭ могут быть симптомы диффузного гломерулонефрита. Мочевой синдром в виде гематурии, протеинурии, цилиндрурии, бактериурии встречается в 25-50% случаев.
Посев крови
Посев крови, по существу, является единственным специфическим методом лабораторной диагностики ИЭ. С одинаковым успехом можно исследовать как венозную, так и артериальную кровь вне зависимости от фазы подъема температуры тела. Посевы крови следует проводить в первые сутки после установления диагноза: при подостром ИЭ — 2 раза и более с интервалом 12 ч, при остром ИЭ — 3 раза и более в течение часа. При отрицательных результатах первичных посевов проводят 2-3 дополнительных посева в течение 48 ч. Кровь берут раздельными венепункциями в объеме около 20 мл у взрослых и 5-10 мл — у детей. Нельзя исследовать кровь из постоянных сосудистых катетеров ввиду высокого риска контаминации посторонней микрофлорой.
Многократные посевы крови существенно повышают вероятность выделения гемокультуры и позволяют дифференцировать истинные патогены (при повторном выявлении микроорганизмов того же вида) от случайных контаминантов, наблюдаемых в 41,5% случаев. При этом среди гемокультур коагулазонегативных стафилококков удельный вес контаминантов достигает 81,9%, а среди изолятов зеленящих стрептококков — 49,3%, что связано с применением внутрисосудистых катетеров и других инвазивных вмешательств, а также с использованием высококачественных питательных сред для выделения гемокультур, обеспечивающих рост контаминантов с кожи даже после тщательной ее дезинфекции перед венепункцией.
Высев возбудителя имеет наибольшее значение в постановке диагноза ИЭ. Отрицательные посевы крови встречаются в 10-15% случаев, причем их количество увеличивается до 40% в случаях антибактериального лечения до забора крови. Идеально в первые сутки заболевания должно быть взято 3-5 посевов крови. В пробирку с тиогликолем берут 3-5 мл крови и инкубируют ее в течение не менее 3 нед для выявления медленно растущих микроорганизмов. Медленно растущие микроорганизмы, например стрептококки желудочно-кишечного тракта, лучше растут на средах с добавлением пиридоксальфосфата или L-цистеина. Данные микроорганизмы необходимо заподозрить в случаях роста грамположительных кокков в медленно растущих колониях.
Отрицательные посевы крови регистрируются в 10-15% случаев ИЭ. Причинами отрицательных посевов крови являются:
• применение антибиотиков до взятия посевов крови;
• ИЭ, вызванные риккетсиями, хламидиями, вирусами;
• ИЭ, вызванные медленно растущими микроорганизмами (Candida, Haemophilus brucella) или стрептококками желудочно-кишечного тракта;
• ИЭ, вызванные анаэробными микроорганизмами;
• небактериальный тромботический эндокардит;
• пристеночный (внутрисердечный) эндокардит;
• правосторонний ИЭ;
• грибковый эндокардит;
• неправильно поставленные диагнозы.
Несмотря на совершенствование техники культивирования крови, в последнее десятилетие отмечается увеличение количества культуронегативных ИЭ, что связано, очевидно, с широким применением антибиотиков на достационарном этапе лечения, а также с увеличением числа случаев заболеваний, вызванных возбудителем небактериальной природы и медленно растущими штаммами микроорганизмов.
Общий анализ крови
• Лейкоцитоз, в острых случаях с развитием сепсиса, может отмечаться лейкопения.
• Увеличение СОЭ регистрируют у 90% больных с ИЭ, коррелирует с гипергаммаглобулинемией, обнаруживаемой при этом заболевании. Артефактное снижение СОЭ отмечается при сопутствующем поражении почек, застойной сердечной недостаточности, полицитемии, синих ВПС. При адекватной терапии отмечается нормализация данного лабораторного показателя.
• Анемия возникает у 40% больных, чаще при хроническом течении заболевания. У детей с синими ВПС нормальные или низкие показатели гемоглобина крови могут быть проявлением ИЭ.
Биохимические и иммунологические анализы крови
Ревматоидный фактор положителен у половины пациентов с ИЭ и подтверждает диагноз при отрицательных посевах крови. Показано, что при адекватной терапии происходит его нормализация.
Установлено, что больные с ИЭ имеют повышенную чувствительность тромбоцитов к агрегации, высокий уровень р-тромбоглобулина в плазме и низкое содержание антитромбина III при нормальном уровне ингибитора α-плазмина, что указывает на слабую гиперкоагуляцию без ускорения фибринолиза. Повышенная склонность к тромбообразованию у больных с ИЭ, наряду с умеренной гиперкоагуляцией, связана с изменением функции тромбоцитов.
Изменения гуморальной системы иммунитета при ИЭ характеризуются поликлональной гипер иммуноглобулинемией или повышением уровня Ig классов M и G.
Циркулирующие иммунные комплексы (ЦИК) выявляют у 63-93% больных с ИЭ. Хотя ЦИК бывают повышены в 10% случаев у больных при острых инфекциях без поражения клапанов сердца и в контроле, их уровень при ИЭ значительно выше. Уровень ЦИК коррелирует с подострым течением и внесосудистыми проявлениями заболевания, персистированием рефрактерной бактериемии, поражением почек. Повышение уровня ЦИК более 12 мг/мл может являться диагностическим критерием при культуронегативных ИЭ. Однако необходимо учитывать, что при стафилококковых ИЭ уровень их существенно не отличается от такового у пациентов с бактериемией без ИЭ. Уровень ЦИК повышается в процессе инфекции и нормализуется после адекватной антибактериальной терапии.
Из иммунологических методов исследования с диагностической целью используют также NBT-тест, позволяющий судить о фагоцитарной активности лейкоцитов. В активной стадии ИЭ показатели возрастают в 5-7 раз по сравнению с контролем.
В случаях культуро негативных ИЭ серологические методы исследований, обнаружение антистрептококковых, антистафилококковых антител могут быть полезны в постановке диагноза. Так, в случаях эндокардита, вызванного золотистым стафилококком, с помощью иммуноферментного анализа возможно обнаружение антител к риботолтейхоевой кислоте. При успешном лечении титр антител снижается. Это позволяет раньше и в большем проценте случаев, чем получение гемокультуры, установить стафилококковую этиологию ИЭ и контролировать эффективность антибактериальной терапии.
Эхокардиография
Ведущим критерием диагностики ИЭ является визуализация бактериальных вегетаций. Первые сообщения о выявлении вегетаций ультразвуковым методом сделал T. Dillon в 1973 г. Однако отсутствие бактериальных вегетаций не исключает диагноза ИЭ. Рекомендации по эхокардиографической диагностике ИЭ разработаны Американской ассоциацией по эхокардиографии.
Одномерная эхокардиография
Чувствительность одномерной методики (М-эхокардиографии) в выявлении бактериальных вегетаций составляет от 13 до 48%. Характерным М-эхокардиографическим признаком вегетаций является обнаружение грубых, нерегулярных эхо-сигналов на створках клапанов (их называют «лохматые»; shaggy).
Этот признак отличается от дрожания створок, обусловленного регургитантным потоком, возникновением в различные фазы систолы и диастолы. Эхо-сигнал от створок значительно усилен, кинетика клапана нарушается в зависимости от особенностей его поражения (стеноза или недостаточности). Следует отметить, что «лохматость» и утолщенность створок не являются высокоспецифичными проявлениями ИЭ. Такие изменения могут наблюдаться при миксоматозном поражении створок (например, пролапсе митрального клапана, синдроме хлопающего клапана). Значительные трудности в определении признаков ИЭ при одномерной эхокардиографии возникают у больных с кальцификацией и фиброзированием створок.
Такие клапаны выглядят толстыми, с нерегулярными вибрациями и «лохматыми» створками. Диагностические проблемы имеют место у больных с эластофиброзом эндокарда вследствие врожденных и приобретенных пороков сердца, а также при определении вегетаций на искусственном клапане, особенно в аортальной позиции (возникает выраженный эффект реверберации). Одномерная эхокардиография позволяет обнаружить только вегетации, превышающие 5 мм в диаметре. Вновь образуемые бактериальные вегетации выявляются значительно труднее, чем кальцифицированные.
Двухмерная эхокардиография
Чувствительность двухмерной эхокардиографии в выявлении бактериальных вегетаций намного превышает одномерную методику и составляет от 81 до 100%. Наименьший размер клапанных вегетаций, обнаруживаемых с помощью двухмерной эхокардиографии, составляет 2-3 мм. Бактериальные вегетации имеют различную форму, чаще сферическую, плотно фиксированы на клапанных структурах, однако могут быть и подвижными. В последнем случае они перемещаются по направлению потока крови, клинически подтверждаются меняющейся аускультативной симптоматикой, чаще осложняются тромбоэмболическим синдромом.
Обнаруженные при первом исследовании вегетации могут несколько видоизменяться в динамике лечения. Рецидив болезни можно заподозрить, если по данным ЭхоКГ отмечается значительное увеличение вегетаций или появление новых. Рост вегетаций при сохраняющейся персистирующей инфекции или появление признаков инфильтрации миокарда могут свидетельствовать о неэффективности терапевтического лечения и служить показанием к проведению хирургического вмешательства.
Крупные размеры вегетаций не всегда ассоциируются с неблагоприятным прогнозом заболевания. Вегетации могут быть в виде единичного узла или множественными, в виде гроздьев винограда. Последние отличаются по эхогенности от клапанных структур или поверхности эндокарда, выглядят плотными, имеют эффект реверберации. Эхокардиографические проявления бактериальных вегетаций при секторном сканировании могут имитировать следующие состояния: миксоматозную дегенерацию при пролапсе митрального клапана, фиброз или кальцификацию, вторичные к ревматизму, спонтанный отрыв хорд, узелки на створках при сосудистых коллагеновых заболеваниях.
Ложноотрицательные случаи диагностики наблюдаются, если вегетации менее 2 мм в диаметре локализуются на глубине более 7 мм от датчика, эхокардиографическое исследование проведено в первые 2 нед от начала заболевания.
Чреспищеводная эхокардиография
Чувствительность и специфичность данного метода во много раз превышают обычное ультразвуковое исследование. Чреспищеводная эхокардиография, в отличие от стандартной методики, позволяет выявить вегетации при стенозе митрального клапана, миксоматозной дегенерации створок, отрыв хорд с вегетациями и без них, микотиче-ские аневризмы с образованием фистул, вегетации на двустворчатом аортальном клапане, перфорацию створок.
Допплерэхокардиография
Допплерэхокардиография позволяет определить локализацию и подвижность бактериальных вегетаций, величину клапанной дисфункции, дифференцировать вегетации от тромбов, опухолей и других аномальных образований. Допплерэхокардиография оказывает существенную помощь в оценке степени тяжести и прогноза заболевания.
Диагностические критерии инфекционного эндокардита
В современной клинической практике для диагностики ИЭ применяют критерии, разработанные научно-исследовательской группой Duke Endocarditis Service из Даремского университета (США) под руководством D. Durack. Данная система критериев предусматривает диагностические градации определенного, возможного и отвергнутого ИЭ.
Определенный инфекционный эндокардит
• Патологические критерии: микроорганизмы, выделенные из вегетаций, эмболов или миокардиальных абсцессов, либо патоморфологические изменения — вегетации или абсцессы миокарда, подтвержденные гистологически.
• Клинические критерии: два больших, или один большой и три малых, или пять малых.
Большие критерии
Позитивная гемокультура. Типичные для ИЭ возбудители, выделенные из двух раздельно взятых проб крови: зеленящие стрептококки (включая штаммы с измененными питательными потребностями), или НАСЕК-группа (Haemophilus spp., Actinobacillus actinimycetemcomitans, Cardiobacterium hominis, Eikenella spp., Kingella kingae), или внебольничные Staphylococcus aureus, или энтерококки при отсутствии первичного очага, или согласующиеся с ИЭ возбудители, выделенные из гемокультуры при следующих условиях: как минимум, два положительных результата исследования проб крови, взятых с интервалом не менее 12 ч, или три положительных результата из трех, или большинство положительных результатов из четырех проб крови и более (интервал между взятием первой и последней пробы должен составлять, как минимум, 1 ч).
Доказательства поражения эндокарда
• Положительные ЭхоКГ-данные: свежие вегетации, или абсцесс, или частичная дегисценция клапанного протеза.
• Вновь сформированная клапанная регургитация (нарастание или изменение имевшегося сердечного шума не учитывается).
Основные:
• лихорадка;
• шум регургитации;
• спленомегалия;
• васкулит.
Диагностическое правило
Достоверный ИЭ: два основных клинических признака плюс два параклинических признака при обязательном наличии шума регургитации.
Вероятный ИЭ: более двух основных клинических признаков плюс один дополнительный клинический признак, или два основных клинических признака плюс один параклинический признак при обязательном наличии шума регургитации во всех вариантах.
К основным клиническим признакам относятся: лихорадка без ограничения уровня температуры тела, шум регургитации, в том числе новый шум или динамика шума у больных с ранее существовавшим порческих признаков. Для установления вероятного ИЭ достаточно более двух основных клинических признаков, или двух основных и одного дополнительного, или двух основных и одного параклинического, при этом во всех случаях обязательно наличие шума регургитации. Данные критерии сопоставимы с критериями Duke по чувствительности для клинической диагностики ИЭ, более радикальны в диагностике достоверного ИЭ, менее зависимы от технического уровня ультразвуковой и бактериологической диагностики, что весьма важно для раннего выявления ИЭ хотя бы в категории вероятного.оком сердца, спленомегалия, не объясняемая другими причинами, и васкулит, включая петехиальную сыпь, узелки Ослера и др.
К дополнительным клиническим признакам отнесены гломерулонефрит и тромбоэмболии. Параклинические проявления разделены на два признака: а) ЭхоКГ-подтверждение, включая вегетации на клапанах и клапанных структурах, протезах, деструктивные изменения клапана, абсцессы, а также подозрение на вегетации при клапанной регургитации; б) лабораторные показатели: положительная гемокультура, и/или анемия, и/ или увеличение СОЭ более 30 мм/ч.
Диагностировать достоверный ИЭ можно при сочетании двух основных клинических признаков, одним из которых обязательно является шум регургитации, и двух параклинических признаков. Для установления вероятного ИЭ достаточно более двух основных клинических признаков, или двух основных и одного дополнительного, или двух основных и одного параклинического, при этом во всех случаях обязательно наличие шума регургитации. Данные критерии сопоставимы с критериями Duke по чувствительности для клинической диагностики ИЭ, более радикальны в диагностике достоверного ИЭ, менее зависимы от технического уровня ультразвуковой и бактериологической диагностики, что весьма важно для раннего выявления ИЭ хотя бы в категории вероятного.
Инфекционный эндокардит — острое или подострое воспаление клапанного и/или пристеночного эндокарда, вызываемое различными инфекционными агентами.
Инфекционный (в том числе абактериальный) эндокардит — одна из серьёзных причин смертности детей и подростков. Вариабельность и неспецифичность его клинической картины вызывают объективные трудности диагностики. Недостаточное знакомство педиатров, стоматологов и родителей с принципами профилактики инфекционного эндокардита, а также увеличение количества лиц, входящих в группы риска (наркоманы, пациенты после оперативных вмешательств на сердце, больные, находящиеся на иммуносупрессивной терапии, с длительной катетеризацией центральных вен и т.д.), приводят к увеличению количества случаев заболевания.
Инфекционный эндокардит может развиться на интактных клапанах (5-6%), но чаще осложняет врождённые (90%) и ревматические (3%) пороки сердца, особенно после оперативных вмешательств по их поводу.
Частота инфекционного эндокардита у детей неизвестна, однако количество больных детей постепенно увеличивается и составляет 0,55 на 1000 госпитализированных. Мальчики болеют в 2-3 раза чаще, чем девочки.
Наиболее частые возбудители инфекционного эндокардита в настоящее время — зеленящий стрептококк и золотистый стафилококк (до 80% случаев заболевания). Первый чаще вызывает заболевание на интактных, второй — на повреждённых клапанах. Реже инфекционный эндокардит вызывают другие микроорганизмы: энтерококки, менинго-, пневмо- и гонококки, эпидермальный стафилококк, хламидии, сальмонеллы, бруцеллы, НАСЕК-группа (объединение нескольких грамотрицательных палочек), а также вирусы и грибы; последние два упомянутых агента вызывают «абактериальную» форму инфекционного эндокардита (около 10% случаев заболевания). При катетеризации сердца и длительном стоянии катетера в центральных венах часто выявляют синегнойную палочку, при операциях на сердце и длительной антибиотикотерапии — грибы (кандиды, гистоплазмы).
Инфекционный эндокардит может быть врождённым и приобретённым.
Врождённый эндокардит развивается при острых или обострении хронических вирусных и бактериальных инфекций у матери и представляет собой одно из проявлений септицемии.
Приобретённый инфекционный эндокардит у детей первых 2 лет жизни возникает чаще на интактных клапанах; у детей более старшего возраста заболевание обычно развивается при наличии порока сердца (как и у взрослых). Предрасполагающим фактором к развитию инфекционного эндокардита выступает операция на сердце.
Предрасполагающие факторы выявляют приблизительно у 30% больных. Оперативные вмешательства, прежде всего на сердце, мочевом тракте и в полости рта, предшествуют развитию инфекционного эндокардита в 65% случаев.
Патогенез инфекционного эндокардита сложен и связан с несколькими факторами: изменённым иммунным ответом организма, дисплазией соединительной ткани сердца, повреждением коллагеновых структур клапанного и пристеночного эндокарда гемодинамическими и инфекционными воздействиями, нарушением реологических свойств и свёртывающей системы крови, особенностями самого возбудителя и др.
Наиболее часто инфекционный эндокардит развивается у пациентов с морфологическими дефектами структур сердца, при которых турбулентный, замедленный или усиленный ток крови приводит к изменению клапанного или предсердного эндокарда (тетрада Фалло, небольшой ДМЖП, открытый боталлов проток, коарктация аорты, пороки митрального клапана). Циркулирующий в крови инфекционный агент оседает на повреждённом или интактном эндокарде сердца и эндотелии крупных сосудов, вызывая воспалительную реакцию, расслоение богатых коллагеном краёв клапанов, отложение на них фибрина и образование тромботических масс (вегетации). Возможно и первичное тромбообразование, связанное с гемодинамическими и реологическими нарушениями (абактериальный эндокардит). В этом случае оседание микроорганизмов на уже изменённых клапанах происходит позднее.
В дальнейшем разрастающиеся вегетации могут отрываться и вызывать эмболии мелких и крупных сосудов большого и малого круга кровообращения.
Выделяют три фазы патогенеза: инфекционно-токсическую, иммуновоспалительную и дистрофическую.
Инфекционно-токсическая фаза формируется как ответная островоспалительная реакция макроорганизма. В этой фазе чаще выявляют бактериемию, тогда как собственно сердечные изменения выражены умеренно, заболевание протекает как острая инфекция с лихорадкой, интоксикацией, воспалительными изменениями периферической крови.
Иммуновоспалительная фаза связана с образованием антител как к антигенам возбудителя, так и к собственным тканям и криоглобулинам. Этот процесс протекает с участием комплемента и формированием ЦИК. Эта фаза сопровождается генерализацией процесса, поражением других внутренних органов и более отчётливыми изменениями в сердце. Её рассматривают как иммунокомплексную болезнь.
Дистрофическая фаза проявляется хроническим воспалением эндокарда и внутренних органов, формированием пороков, отложением солей кальция в клапанных структурах, гемодинамической сердечной недостаточностью. Возможны выявление порока сердца через несколько лет после выздоровления и повторное заболевание инфекционным эндокардитом.
В клинической картине ведущую роль играют три основных синдрома: инфекционно-токсический, кардиальный (текущий эндокардит) и тромбоэмболический.
Инфекционный эндокардит, особенно стрептококковой этиологии, может начинаться постепенно — с повторных эпизодов повышения температуры тела в вечерние часы, недомогания, артралгий, миалгий, потливости, немотивированной потери массы тела. Возможно и острое начало — с гектической лихорадки, резкого нарушения общего состояния, потрясающих ознобов и профузных потов (чаще при инфицировании стафилококком).
В инфекционно-токсическую фазу эндокардит может не иметь отчётливых клинических проявлений, хотя уже через несколько дней от начала заболевания можно выслушать протодиастолический шум недостаточности аортального клапана. При вторичном эндокардите меняются количество и характер шумов в области уже изменённого клапана. В этот период возможны проявления тромбоэмболии: геморрагическая сыпь, периодическая гематурия, инфаркты внутренних органов. Пятна Лукина-Либмана на конъюнктиве, пятна Джейнуэя на ладонях и стопах, полосчатые геморрагии под ногтями, свидетельствующие о васкулите, при своевременно начатом лечении возникают редко.
В иммуновоспалительную фазу происходят генерализация иммунопатологического процесса и присоединение миокардита, а иногда и перикардита, диффузного гломерулонефрита, анемии, поражения лимфатических узлов, печени, селезёнки. Цвет кожных покровов становится серовато-желтушным («кофе с молоком»), иногда развивается желтуха. Текущий процесс в сердце проявляется умеренным болевым синдромом, тахикардией, кардиомегалией и глухостью тонов (при сопутствующем миокардите). Появляются шумы, сопровождающие порок или деструкцию клапанного аппарата (отрыв хорд или створок клапана, их перфорация). Эмболии и инфаркты в эту фазу болезни наблюдают реже.
В дистрофической фазе на первый план выступает недостаточность — сердечная, почечная, иногда печёночная — как следствие тяжёлого поражения внутренних органов при генерализованном иммунопатологическом процессе.
В некоторых случаях особенности клинической картины инфекционного эндокардита позволяют предположить, какой именно инфекционный агент послужил причиной его развития. Об особенностях стрептококковых и стафилококковых эндокардитов уже упоминалось выше.
Пневмококковый эндокардит развивается в период реконвалесценции при заболевании пневмонией, локализуется на трёхстворчатом и аортальном клапанах, протекает с высокой лихорадкой, выраженным токсикозом, периферическими бактериальными эмболиями.
Бруцеллёзный эндокардит имеет такую же локализацию, что и пневмококковый. Иногда он вызывает образование бактериальных аневризм синуса Вальсальвы с переходом инфекции через стенку аорты на предсердия, желудочки и другие оболочки сердца с развитием внутрипредсердной и внутрижелудочковых блокад.
Сальмонеллёзный эндокардит приводит к деструкции аортального и митрального клапанов с образованием тромбов, повреждению эндотелия сосудов и развитию эндартериита и сосудистых аневризм.
Грибковый эндокардит сопровождается развитием инфарктов лёгких, пневмоний, увеита и эндофтальмита.
Осложнения инфекционного эндокардита включают сердечную и почечную недостаточность, последствия тромбоэмболии в виде инфарктов головного мозга и миокарда, абсцессов головного мозга и других органов. Перечисленные осложнения можно расценивать и как проявления терминальной фазы болезни. Возможно развитие перикардита, менингита, артрита, остеомиелита и других гнойных процессов.
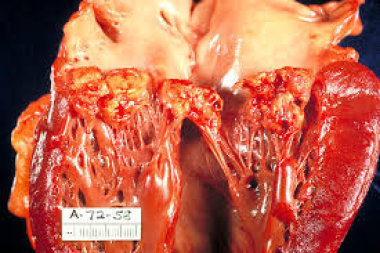
Проблема инфекционного эндокардита (ИЭ) актуальна во многих странах мира. Согласно данным многочисленных зарубежных исследований, заболеваемость ИЭ составляет 3–10 случаев на 100 тыс. человек в год. В течение последних десятилетий увеличилось количество и
The problem of infectious endocarditis (IE) is significant in many countries of the world. According to the data of numerous foreign studies, occurrence of IE is 3–10 cases for 100 000 people per year. During the last decades, the number of risk factors for this disease has increased, and their correlation has changed. Injective drug-addiction, cardio-surgical operations, and invasive medical manipulations (prolonged intravenous line, hemodialysis) are playing the key role now.
Проблема инфекционного эндокардита (ИЭ) актуальна во многих странах мира. Согласно данным многочисленных зарубежных исследований, заболеваемость ИЭ составляет 3–10 случаев на 100 тыс. человек в год. Несмотря на проведение современных методов диагностики, в том числе трансэзофагеальной эхокардиографии, мультиспиральной компьютерной томографии, магнитно-резонансной томографии, масс-спектрометрии и полимеразной цепной реакции, установленные алгоритмы проведения бактериологического исследования крови, использование схем рациональной антимикробной терапии (АМТ), летальность при ИЭ остается высокой, составляя более 20% [1].
В течение последних десятилетий увеличилось количество и изменилось соотношение основных факторов риска данной нозологии. Наиболее важную роль стали играть инъекционная наркомания, кардиохирургические операции и инвазивные медицинские манипуляции (длительная катетеризация вен, гемодиализ), что привело к смене ведущего возбудителя, которым в настоящее время, согласно большинству исследований, является Staphylococcus aureus [6].
В этиологической структуре ИЭ ведущую роль традиционно играют грамположительные микроорганизмы. Среди них наиболее часто выделяют Staphylococcus aureus, Streptococcus viridans, коагулазанегативный стафилококк и Enterococcus spp.
В последние годы отмечается рост резистентности большинства возбудителей ИЭ к антимикробным препаратам, применяемым в клинической практике. Распространенность резистентности может значительно различаться в разных странах и географических регионах. В случае ИЭ основную проблему представляют метициллинорезистентные штаммы стафилококков и штаммы Enterococcus spp. с высоким уровнем резистентности к аминогликозидам.
Высокие цифры смертности при ИЭ во многом обусловлены развитием потенциальных осложнений, среди которых наиболее часто отмечаются развитие и прогрессирование сердечной недостаточности, тромбоэмболические проявления, развитие инфекционных аневризм, а также поражение внутренних органов различной локализации [2].
Материалы и методы
Было проведено многоцентровое исследование этиологии, антибиотикорезистентности и фармакоэпидемиологии инфекционного эндокардита, состоящее из двух частей: проспективной (сентябрь 2011 г. — декабрь 2016 г.) и ретроспективной (январь 2006 г. — август 2011 г.).
В исследование включались пациенты обоего пола всех возрастных групп с определенным и вероятным ИЭ. Диагноз ИЭ выставлялся согласно критериям Duke. В исследование включено 406 (в проспективной части — 166, в ретроспективной — 240) случаев ИЭ.
Пациенты находились на стационарном лечении в 11 лечебных учреждениях 9 городов Российской Федерации (Архангельск, Казань, Москва, Омск, Санкт-Петербург, Смоленск, Тюмень, Якутск, Ярославль). Все стационары, принявшие участие в исследовании, имеют многопрофильный характер и располагают собственной микробиологической лабораторией.
Идентификация микроорганизмов проводилась согласно рутинной локальной практике. Определение чувствительности выделенных штаммов стафилококков и энтерококков проводилось диско-диффузионным методом.
Критериями включения в исследование были: наличие диагноза определенного или вероятного ИЭ в карте стационарного больного, факт взятия хотя бы одного образца крови для бактериологического исследования, проведенная эхокардиография, доступность медицинской документации.
В ходе исследования на каждого пациента собирались анамнестические и клинические данные, которые вносились в специально разработанные индивидуальные регистрационные карты и в дальнейшем вводились с использованием метода двойного ввода в специализированную базу данных, разработанную на основе базы управления данными Microsoft Access для Windows. Статистическая обработка данных проводилась с помощью статистического пакета SAS Institute, США, версия 8.02 для Windows XP.
Результаты исследования
В настоящее время диагностика ИЭ базируется на общепризнанных Duke-критериях, в которых выделяют большие и малые критерии [7, 8].
В структуре больших критериев ИЭ в общем выделение этиологически значимых возбудителей при бактериологическом исследовании крови отмечалось в 35,5%, эхокардиографические признаки поражения эндокарда в 99,5%. В проспективном исследовании аналогичные показатели составили — 31,5% и 100,0%, в ретроспективном исследовании — 38,1% и 99,2% соответственно.
В структуре малых критериев ИЭ в общем иммунные проявления отмечались в 11,1%, лихорадка в 93,8%, микробиологические признаки, не соответствующие основному критерию, — в 2,2%, предрасполагающие факторы поражения сердца и инъекционная наркомания — в 77,3%, сосудистые проявления — в 38,2%. В проспективном исследовании аналогичные показатели составили — 9,6%, 96,4%, 4,2%, 77,1%, 33,1%, в ретроспективном исследовании — 12,1%, 92,1%, 0,8%, 77,5%, 41,7% соответственно.
Факторы риска в значительной степени определяют структуру возбудителей ИЭ и имеют важное значение в диагностике.
В общей структуре исследования среди факторов риска ИЭ в большинстве случаев отмечались: инъекционная наркомания — 39,2%, приобретенный порок сердца — 33,2%, ранее перенесенный ИЭ — 18,3% (рис. 1).
.gif)
В проспективной части исследования среди факторов риска наиболее часто отмечались приобретенный порок сердца — 36,1%, инъекционная наркомания — 30,4%, ранее перенесенная операция на сердце — 19,4%, ранее перенесенный ИЭ — 18,8%.
В ретроспективном исследовании среди факторов риска наиболее часто отмечались инъекционная наркомания — 42,7%, приобретенный порок сердца — 31,3%, ранее перенесенный ИЭ — 18,0%.
Бактериологическое исследование крови проводилось многократно в 52,7% случаев, однократно в 47,3%. Наиболее существенным аспектом данного исследования является необходимость его проведения до назначения АМТ. Согласно полученным данным, своевременность проведения бактериологического исследования крови отмечена в 20,9%, в проспективном исследовании только в 19,3%, в ретроспективном — в 22,1%.
Среди визуализирующих методов диагностики наибольшее значение имеет эхокардиография, позволяющая в большинстве случаев выявить патологические изменения на клапанном аппарате сердце [10].
При проведении эхокардиографии в общей структуре исследования в 84,2% использовалась только трансторакальная эхокардиография, только трансэзофагеальная эхокардиография в 3,7%, сочетание трансторакальной и трансэзофагеальной эхокардиографии в 12,1%. В проспективном исследовании аналогичные показатели составили — 75,3%, 4,8%, 19,9%, в ретроспективном исследовании — 90,4%, 2,9% и 6,7%.
Наиболее частой локализацией поражения в общей структуре исследования был митральный клапан — 43,6%, аортальный клапан поражался в 37,9%, трехстворчатый клапан в 34,7%, клапан легочной артерии в 0,5% случаев. В проспективной части исследования наиболее часто поражался митральный клапан — 44,6%, аортальный клапан поражался в 39,8%, трехстворчатый клапан в 34,3%, клапан легочной артерии в 0,6%. В ретроспективной части исследования наиболее часто поражался митральный клапан — 42,9%, аортальный клапан поражался в 36,7%, трехстворчатый в 35%, клапан легочной артерии в 0,4% случаев.
Этиотропная направленность АМТ пациентов с ИЭ подробно освещена в современных зарубежных рекомендациях и играет ключевую роль при выборе наиболее корректного лечения [3]. С учетом этого обстоятельства была проведена микробиологическая идентификация включенных в исследование случаев.
В общей структуре исследования из 406 случаев в 144 (35,5%) был выделен этиологически значимый возбудитель. Преобладали грамположительные микроорганизмы — 130 (90,3%), а среди них — Staphylococcus aureus (46,5% от всех выделенных возбудителей) (рис. 2).
.gif)
В течение последних десятилетий отмечается глобальный рост антибиотикорезистентности среди возбудителей большинства инфекций, во многом предопределяющий эффективность АМТ [9, 11].
В общей структуре проведенного исследования из 67 идентифицированных штаммов Staphylococcus aureus 19 (28,4%) являлись метициллинорезистентными. Из 23 штаммов коагулазанегативного стафилококка 8 (34,8%) являлись метициллинорезистентными. Среди выделенных 23 штаммов Enterococcus spp. преобладали 13 (56,5%), резистентные к гентамицину.
Обсуждение результатов исследования
Значимость проблемы ИЭ подтверждается отсутствием тенденции к снижению заболеваемости и смертности при данной патологии [5].
Улучшение ведения пациентов с ИЭ невозможно без знания особенностей диагностики и терапии, четких представлений об этиологической структуре, учета глобальных и локальных данных об антимикробной резистентности наиболее часто встречающихся возбудителей. В этой связи чрезвычайно важной представляется совместная эффективная работа клинических микробиологических лабораторий с целью получения достоверных данных о возбудителях и их чувствительности к антимикробным препаратам и врачей, занимающихся лечением пациентов с ИЭ. Одним из способов получения подобной информации является участие в многоцентровых исследованиях, проводимых по единому протоколу.
Современная диагностика ИЭ основывается на предложенных в 1994 г. и впоследствии дополненных Duke-критериях, согласно которым ключевая роль в диагностике ИЭ отводится бактериологическому исследованию крови и визуализирующим методам диагностики [7, 8].
Наиболее часто используемым из визуализирующих методов диагностики ИЭ является эхокардиография, проведение которой позволяет определить локализацию поражения, размеры микробных вегетаций, степень и динамику компенсации поврежденного клапана, что в свою очередь определяет дальнейшую тактику ведения пациентов с ИЭ [10]. Согласно проведенному исследованию, в 84,2% использовалась исключительно трансторакальная эхокардиография, информативность которой по сравнению с трансэзофагеальной существенно ниже. Это обуславливает необходимость оптимизации диагностического процесса пациентов с ИЭ.
В последние годы увеличилось количество публикаций, свидетельствующих о потенциальной роли в диагностике инфекционного поражения эндокарда компьютерной томографии и магнитно-резонансной томографии. При этом следует отметить, что на сегодняшний день данные методы исследования не вошли в рутинную практику и их применение при ИЭ в основном ограничено диагностикой тромбоэмболических осложнений, а также поиском истинного диагноза при лихорадке неясного генеза [3].
В ходе проведения настоящего исследования наиболее частой локализацией инфекционного поражения был митральный клапан (43,6%). Это согласуется с данными большинства современных исследований. Следует также отметить достаточно высокие цифры поражения трехстворчатого клапана (34,7%), что можно объяснить высокой частотой инъекционной наркомании и других факторов риска (катетеризация центральных вен, инвазивные манипуляции на крупных сосудах и сердце), способствующих повреждению данного клапана [2].
Характеризуя результаты бактериологического исследования крови в данном исследовании, следует отметить достаточно низкий уровень выделения этиологически значимых возбудителей. В настоящем исследовании этиология установлена в 35,5%. Ключевое значение в данной ситуации имеет тот факт, что в подавляющем большинстве случаев, согласно проведенному исследованию — в 79,1%, взятие образцов крови происходило после назначения АМТ.
В структуре факторов риска проведенного исследования преобладали инъекционная наркомания и приобретенный порок сердца, 39,2% и 33,2% соответственно. Это подтверждается современными зарубежными данными, согласно которым имеет место тенденция к увеличению числа случаев ИЭ, развивающихся на фоне инъекционной наркомании и применения диагностических инвазивных манипуляций на сердце и крупных сосудах, а также случаев вторичного ИЭ [11].
В качестве возбудителей ИЭ может выступать довольно значительное количество микроорганизмов, большинство из которых являются грамположительными бактериями. Это находит четкое подтверждение в современных исследованиях ИЭ [2].
Вместе с тем за последние десятилетия в этиологической структуре ИЭ произошли существенные изменения. Основным из таких изменений является то, что ведущим возбудителем стал Staphylococcus aureus, вместо Streptococcus viridans. Данная тенденция наблюдается в большинстве стран, в том числе и в Российской Федерации. Согласно данным проведенного исследования, частота выделения Staphylococcus aureus и Streptococcus viridans составила 46,5% и 11,8% соответственно. Это в свою очередь объясняется изменениями в соотношении факторов риска данной патологии. Среди них первостепенное значение в настоящее время играют инъекционная наркомания, инвазивные диагностические и лечебные манипуляции на сердце и крупных сосудах, в то время как стоматологические манипуляции и плохая гигиена полости рта играют второстепенное значение [6].
Следует также отметить, что изменения в этиологической структуре ИЭ и ведущее значение Staphylococcus aureus среди возбудителей в значительной степени объясняют и высокие цифры летальности при ИЭ. Ввиду того что Staphylococcus aureus продуцирует токсины, вызывающие изменения в свертывающей системе крови, в настоящее время имеет место значительное количество тромбоэмболических осложнений у пациентов с ИЭ [2].
Обращает на себя внимание увеличение доли штаммов MRSA как в общей структуре инфекционной патологии, так и при ИЭ. Согласно настоящему исследованию, среди всех случаев выделения Staphylococcus aureus в 28,4% были выделены штаммы MRSA. При этом доля MRSA в проспективном исследовании составила 40%, в ретроспективном — 18,9%. К сожалению, ограниченность выборки не позволила получить статистически достоверные различия. Вместе с тем тенденция нарастания метициллинорезистентности Staphylococcus aureus вызывает серьезные опасения в связи с тем, что при бактериемии, вызванной MRSA, имеет место снижение активности одного из ключевых препаратов при терапии ИЭ — ванкомицина.
В подтверждение важности данной проблемы служит тот факт, что, согласно многочисленным литературным данным, в частности метаанализу, включившему 31 научное исследование с общим количеством случаев бактериемии, вызванной Staphylococcus aureus, 3963, смертность при бактериемии, вызванной MRSA, существенно выше, по сравнению с бактериемией, вызванной MSSA (p = 0,007) [9].
Наряду с увеличением роли Staphylococcus aureus при ИЭ, имеет место тенденция и к увеличению выделения Enterococcus spp. Вероятной причиной этого служит высокая частота патологии органов брюшной полости и малого таза и, как следствие, то, что на сегодняшний день Enterococcus spp. является одним из основных возбудителей амбулаторных и нозокомиальных случаев бактериемии. В проведенном исследовании доля выделенных штаммов Enterococcus spp. составила 16,0%. Наметившийся рост количества случаев ИЭ, вызванного энтерококками, вызывает озабоченность, обусловленную тем, что данные микроорганизмы обладают дефектной системой аутолиза, способствующей потенциальному развитию рецидивов.
Увеличение количества потенциальных факторов риска привело к тому, что в течение последних десятилетий в этиологической структуре ИЭ представлены грамотрицательные микроорганизмы, частота выделения которых в большинстве случаев составляет 6–10%. Это подтверждается результатами и настоящего исследования, согласно которому доля грамотрицательных бактерий в этиологической структуре ИЭ составила 9,7%. Существенное внимание уделяется группе медленно растущих, требующих особых условий культивирования грамотрицательных палочек, объединяемых аббревиатурой НАСЕК и являющихся представителями микробиоты ротовой полости. Несмотря на то, что, согласно подавляющему количеству исследований, грамотрицательные бактерии в настоящее время не являются ведущими возбудителями ИЭ, необходимо учитывать вероятность данных микроорганизмов в этиологии ИЭ при соответствующих факторов риска ввиду того, что в данных случаях (за исключением бактерий группы HACEK) режимы терапии ИЭ будет носить принципиально иной характер [2, 11].
В заключение следует отметить, что для обеспечения высокоэффективных мер контроля ИЭ прежде всего необходимо знать особенности структуры факторов риска и возбудителей данной нозологии и осуществлять регулярный мониторинг за динамикой их резистентности к антимикробным препаратам. Знание этих показателей позволит не только более эффективно бороться с ИЭ, но и оптимизировать АМТ, что, в свою очередь, позволит повысить эффективность лечения больных и снизить экономические потери медицинских учреждений. Вместе с тем до сих пор в Российской Федерации недостаточно данных, характеризующих проблемы диагностики и терапии ИЭ. Ориентироваться только на данные зарубежных исследований нельзя, в связи с потенциальными различиями в структуре факторов риска и политике применения антимикробных препаратов в Российской Федерации и за рубежом.
Выводы
- Учитывая низкий уровень определения этиологически значимых возбудителей при ИЭ в Российской Федерации, расшифровка факторов риска (определение потенциальных возбудителей) данной нозологии имеет важное значение.
- В структуре факторов риска ИЭ в Российской Федерации преобладают инъекционная наркомания и приобретенный порок сердца.
- Наиболее частым возбудителем ИЭ в Российской Федерации является Staphylococcus aureus.
- Для подбора оптимальных режимов эмпирической и этиотропной терапии крайне важно продолжить дальнейшее изучение структуры факторов риска и этиологии ИЭ.
Литература
- Данилов А. И., Кречикова О. И. A. actinomycetemcomitans: клиническое значение, диагностика, антимикробная терапия // Клиническая микробиология и антимикробная химиотерапия. 2012; 14 (4): 276–279.
- Данилов А. И., Козлов Р. С., Козлов С. Н., Дехнич А. В. Практика ведения пациентов с инфекционным эндокардитом в Российской Федерации // Антибиотики и химиотерапия. 2017; 62 (1–2): 7–11.
- Данилов А. И., Козлов С. Н., Евсеев А. В. Обновленные рекомендации Европейского общества кардиологов по ведению пациентов с инфекционным эндокардитом // Вестник Смоленской государственной медицинской академии. 2017; 16 (1): 63–69.
- Дехнич А. В., Данилов А. И. Даптомицин: обзор фармакологических, клинических и микробиологических параметров // Клиническая микробиология и антимикробная химиотерапия. 2010; 12 (4): 295–313.
- Моисеев В. С., Котова Е. О., Караулова Ю. Л. Эпидемиология и клиническое течение современного инфекционного эндокардита (по данным муниципальной больницы) // Клиническая фармакология и терапия. 2014; 23 (3): 62–66.
- Чипигина Н. С., Белостоцкий А. В. Инфекционный эндокардит: изменение предрасполагающих факторов и эволюция возбудителей // Сердце: журнал для практикующих врачей. 2010; 9 (4): 242–250.
- Durack D., Lukes D. K., Briqht D. K. et al. New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Duke Endocarditis Service // American Journal of Medicine. 1994; 96 (3): 200–209.
- Li J., Sexton D. J., Mick N. et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis // Clinical Infectious Disease. 2000; 30 (4): 633–638.
- Taylor A. Methicillin-resistant Staphylococcus aureus infections // Primary Care. 2013; 40 (3): 637–654.
- Wonq D., Keynan Y., Rubinstein E. Comparison between transthoracic and transesophageal echocardiography in screening for infective endocarditis in patients with Staphylococcus aureus bacteremia // European Journal of Clinical Microbiology and Infectious Diseases. 2014; 33 (11): 2053–2059.
- Yew H., Murdoch D. Global trends in infective endocarditis epidemiology // Current Infectious Disease Reports. 2012; 14 (4): 367–372.
А. И. Данилов 1
Т. А. Осипенкова
Р. С. Козлов, доктор медицинских наук, профессор, член-корреспондент РАН
ФГБОУ ВО СГМУ МЗ РФ, Смоленск
Современные особенности инфекционного эндокардита в Российской Федерации/ А. И. Данилов, Т. А. Осипенкова, Р. С. Козлов
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 54-57
Теги: сердце, инфекции, факторы риска