Содержание:
Бокерия Л.А., Бокерия О.Л., Биниашвили М.Б.
Резюме
Ключевые слова
Статья
Авторы: Бокерия Л. А. – академик РАН и РАМН, директор ФГБУ «НЦССХ им. А.Н. Бакулева» РАМН; Бокерия О. Л. – д.м.н., профессор, главный научный сотрудник ФГБУ «НЦССХ им. А.Н. Бакулева» РАМН; Биниашвили М. Б. – к.м.н, младший научный сотрудник ОХЛИП ФГБУ «НЦССХ им. А.Н. Бакулева» РАМН, врач-кардиохирург.
Фибрилляция предсердий (ФП) является одним из самых частых видов нарушения сердечного ритма. В среднем, у 25% людей, старше 40 лет, существует риск развития ФП в течение жизни [1, 2]. У пациентов с ФП высокие показатели заболеваемости и смертности по причине развития кардиомиопатий, обусловленной тахикардией, гемодинамических нарушений, тромбоэмболий, что причиняет серьезный ущерб здоровью населения. Для лечения ФП широко применяются антиаритмическая терапия, методы катетерной и хирургической аблации.
Медикаментозная терапия имеет значительные ограничения в использование, а современные антиаритмические препараты неэффективны в более чем 60% случаев в некоторых сериях [3, 4]. К сожалению, большие перспективы, которые были возложены на методы эндоваскулярной катетерной аблации в лечении ФП, также себя не оправдали. В общем, одна процедура может достигать эффективности от 40% до 70% у пациентов с пароксизмальной формой ФП; хотя некоторые сообщения говорят о частоте эффективности более чем 80% [5, 6]. Результаты лечения персистирующей и хронической формы ФП еще менее эффективны [7].
На сегодняшний день хирургическое лечение ФП является самым эффективным. У хирургов есть определенные преимущества для выполнения эффективной аблации, включающие в себя непосредственный осмотр структур, подвергающихся аблации, относительно несложную технику самой хирургии, и возможность выполнения резекции ушка ЛП, которое является источником тромбоэмболии у пациентов с ФП, перенесших инсульт.
Хирургические методы аблации имеют большую историю, занимающую более чем 20 лет. Классическая операция «Лабиринт» позволила восстанавливать синусовый ритм на длительное время, более чем у 90% пациентов с ФП [8]. Эффективность классической операции «Лабиринт» была подтверждена многими медицинскими Центрами, в том числе и Научным Центром Сердечно-Сосудистой Хирургии имени А.Н. Бакулева, где эти операции стали выполняться одним из первых в мире [9-11]. Хотя данная операции оказалась весьма эффективной, сложность техники проведения, необходимость длительного искусственного кровообращения, а также высокий риск кровотечений, ограничили её широкомасштабное внедрение в клиническую практику [12].
В последнее время много усилий было возложено на разработку различных альтернативных источников энергии, способных создавать линии электрической изоляции в миокарде, вместо традиционной техники «разрез-шов» [13, 14].
В НЦССХ им. А.Н. Бакулева РАМН, основываясь на большом опыте использования методики холодовой аблации в лечении нарушений ритма сердца, под руководством академика РАН и РАМН Л.А. Бокерия, была разработана оригинальная методика хирургического лечения ФП, с помощью криомодификации операции «Лабиринт». Во время проведения операции, выполнение широкого двухпредсердного доступа, обеспечивает возможность эффективной криоаблации, по аналогии с классической схемой операции «Лабиринт», а также дает возможность корригировать патологию клапанов сердца при необходимости. Первоначальные результаты операции показали высокую ее эффективность в восстановление синусового или предсердного ритма у пациентов, как с изолированной формой ФП, так и с сопутствующей кардиальной патологией. Мы представляем клинический случай успешной хирургического лечения ФП с помощью криомодификации операции «Лабиринт», в сочетание с коррекцией относительной недостаточности митрального и трикуспидального клапанов.
Пациент М., 48 лет, поступил в НЦССХ им. А.Н. Бакулева РАМН с жалобами на неритмичное сердцебиение, усиливающееся при физической нагрузке, одышку при умеренной физической нагрузке (при подъеме на 3 этаж), снижение толерантности к физическим нагрузкам. Из анамнеза можно отметить, что в возрасте 45 лет пациент впервые почувствовал перебои в работе сердца, кратковременные пробежки неритмичного сердцебиения продолжительностью от нескольких секунд, до нескольких минут, купирующиеся самостоятельно. Не обращался за медицинской помощью, не лечился. 3 года назад, во время планового медосмотра, на Электрокардиографии (ЭКГ) зарегистрирована ФП, нормоформа. Был направлен в стационар, где выполнена электроимпульстная терапия с восстановлением синусового ритма. В течение года нарушение ритма не беспокоили, однако в последующем вновь началась ФП. Неоднократно обращался за медицинской помощью, однако попытки восстановления ритма были безуспешны. Год назад выполнена процедура эндоваскулярной катетерной аблации, однако должного эффекта она не дала. Назначена антиаритмическая терапия — соталекс по 40 мг 2 раза в сутки, дигоксин 1/2 таб 1 раз в сутки 5 раз в неделю, а также варфарин в дозе 10 мг 1 раз в сутки (при этом МНО 2.0-3.0). Кордарон противопоказан — в анамнезе струмэктомия, принимает L-тироксин. Пациент был госпитализирован в НЦССХ им. А.Н. Бакулева РАМН для дообследования и определения дальнейшей тактики лечения.
При поступлении Общее состояние средней тяжести. Тяжесть состояния обусловлена основным заболеванием (постоянной формой нарушения ритма). Сознание ясное. Активность полная. Конституционные особенности гиперстеник. Рост 181 см, вес 114 кг. Строение тела правильное. Развитие подкожной клетчатки повышено. Отёков нет. Окраска кожных покровов обычная. Окраска слизистых бледно-розовая. Язык чистый, влажный. Лимфатические узлы не увеличены. Мышцы развиты правильно.
Дыхательная система. Грудная клетка правильной формы. Дыхание жесткое, проводится во все отделы. Хрипов нет. Тоны сердца приглушены, ритм неправильный. На верхушке сердца определяется слабый систолический шум. Частота сердечных сокращений (ЧСС) 70 уд/мин. Артериальное давление (АД) 110/70 мм. рт. ст. Пульс слабого наполнения. Аппетит сохранен. Печень не увеличена. Селезенка не пальпиурется. Живот мягкий, безболезненный. Симптом Пастернацкого отрицательный с обеих сторон. Физиологические отправление в норме.
Выполнено комплексное лабораторное и инструментальное обследование.
Электрокардиография (ЭКГ). Ритм ФП с ЧСС 70 ударов в минуту. PQ — 0,16 секунд, QRS — 0,09 секунд. Признаки гипертрофии левого желудочка.
Рентгенография органов грудной клетки. Легочный рисунок умеренно усилен за счет пневмосклероза, без видимых инфильтративных и активных очаговых теней. Структура корней сохранена. Синусы свободные. Границы сердца не изменены.
Эхокардиография (ЭхоКГ). Левое предсердие (ЛП) увеличено в размерах — 4,5 см х 5.0 см х 6.1 см. Левый желудочек: конечно диастолический объем 120 мл; фракция выброса (по Teicholtz) 61 %. Митральный клапан: створки несколько уплотнены, движение разнонаправленное. Диаметр фиброзного кольца 3,8 см. Степень регургитации 2-2,5 (Рисунок 1). Градиент давления пиковый — 5 мм. рт. ст. Трикуспидальный клапан: творки подвижные, разнонапраленные. Диаметр фиброзного кольца 4,0 см. Степень регургитации 2. Аортальный клапан и восходящая аорта без особенностей. Расчетное давление в ПЖ — 35 мм. рт. ст.

Рисунок 1.По данным эхокардиографии отмечается расширение фиброзного кольца митрального кольца 38 мм, с развитием относительной недостаточности 2 степени.
Заключение: дилатация левого предсердия, относительная недостаточность митрального и трикуспидального клапанов. По данным чрезпищеводной эхокардиографии данных за тромбоз ушка ЛП не получено.
Ультразвуковое допплеровское исследование периферических сосудов. Гемодинамически значимых препятствий кровотоку в брахиоцефальных артериях не выявлено. Умеренная S-извитость от устья правой позвоночной артерии, непрямолинейный ход позвоночных артерий в канале. Артерии и вены верхних и нижних конечностей без патологии.
Гастроскопия. Поверхностный гастрит. Противопоказаний к операции нет.
Мультиспиральная компьютерная томография сердца. ЛП увеличено, объем ЛП с учетом ушка ЛП 125 мл. Устья легочных вен расширены. ЛВ справа расположены типично. ЛВ слева впадают в ЛП коротким стволом диаметром 33 мм, протяженностью 10 мм. Контрастирование ЛП равномерное, без дефектов (Рисунок 2).

Рисунок 2. 3D Мультиспиральная компьютерная томография левого предсердия. Объем левого предсердия увеличен до 125 мл.
Ангиокардиография. Правый тип кровоснабжения миокарда. Коронарные артерии без гемодинамически значимых сужений.
Электрофизиологическое исследование (ЭФИ). Исходно регистрируется ФП с частотой желудочковых сокращений от 75 до 90 уд/мин. Проведено электроимпульсное воздействие – восстановлен синусовый ритм с ЧСС 50 уд/мин. Выполнено ЭФИ, по данным которой выявлена слабость синусового узла. Данных за дополнительные пути предсердно-желудочкового соединения, атриовентрикулярную узловую тахикардию, желудочковую тахикардию не получено. Пациент переведен в отделение на синусовом ритме с ЧСС 65 ударов в мин.
Выставлен клинический диагноз: Нарушение ритма сердца. Персистирующая форма ФП. Относительная недостаточность митрального и трикуспидального клапана II степени. Недостаточность кровообращения 2А степени (по Стражеско-Василенко). Функциональный класс II по NYHA.
Учитывая выраженную атриомегалию с развитием недостаточности атриовентрикулярных клапанов, 11 марта 2012 года пациенту была выполнена хирургическая коррекция порока – криомодификация операции «Лабиринт» в сочетании с пластикой митрального и трикуспидального клапанов сердца.
Методика криоаблации.
Криоаблация выполнялась с помощью системы для холодовой аблации ATS CryoMaze (ATS Medical, Inc., USA). Система состоит из основного генератора, который обеспечивает контроль и подачу аргона (Рис. 3). Сама аблация выполняется с помощью гибкого металлического наконечника, в который встроены термодатчики (Рис. 4). Благодаря своей гибкости, можно изменять форму и геометрию наконечника, что позволяет воспроизводить линии криоаблации соответственно формам и размерам предсердий каждого отдельного пациента. Режим каждого воздействия: -95˚С в течение 2 мин.

Рисунок 3. Генератор системы для холодовой аблации ATS CryoMaze.

Рисунок 4. Металлический гибкий наконечник прибора ATS CryoMaze.
Протокол выполнения операции.
Срединная стернотомия. Продольно вскрыт перикард. Канюляция аорты, раздельная канюляция полых вен. По стандартной схеме начато искусственное кровообращение с гипотермией 28С. Через верхнюю правую легочную вену дренирован левый желудочек. Пережата аорта. Кардиоплегия антеградно в корень аорты раствором Кустодиол 2000 мл. Вскрыто правое предсердие (ПП). Выполнена криоаблация в области правого нижнего перешейка сердца. Выполнен расширенный двухпредсердный доступ к митральному клапану через межпредсердную перегородку и купол ЛП. После инвагинации ушка ЛП выполнена криоаблация его основания (Рисунок 5). Далее выполнена аблация правой верхней и нижней легочных вен единым блоком, левой верхней и нижней легочных вен с переходом на заднюю стенку ЛП (режимы — 95 С в течение 2 мин) (Рисунок 6). Митральный клапан (МК): створки тонкие, подвижные, фиброзное кольцо расширено. Выполнена линейная шовная пластика МК, с сужением фиброзного кольца на трех прокладках, нитью пролен 5/0, на буже 28 мм. Гидропроба — хорошая функция МК. Ушиты купол левого предсердия, межпердсердная перегородка. Трикуспидальный клапан (ТК): створки тонкие, фиброзное кольцо расширено, при гидропробе отмечается недостаточность. Выполнена пластика ТК по ДеВега нитью пролен 4/0. Гидропроба — хорошая функция ТК. Ушито правое предсердие нитью пролен 5/0. Согревание больного. Отпущены полые вены. Заполнение камер сердца с профилактикой воздушной эмболии. Отпущена аорта. Самостоятельное восстановление сердечной деятельности через узловой ритм. Подшиты миокардиальные электроды: два к правому желудочку, к ЛП и ПП. Навязана бифокальная стимуляция с ЧСС 90 уд/мин. Выполнена перевязка ушка ЛП. Стабилизация гемодинамики. Завершение искусственного кровообращения на минимальных дозах кардиотонической поддержки (допамин 5 мкг/кг/мин, добутамин 5 мкг/кг/мин). Деканюляция. Тщательный гемостаз. На этапе выполнения гемостаза проверка параметров сердечного ритма – отмечается предсердный ритм с ЧСС 70 уд/мин. ЭКС переведен в режиме «demand» с ЧСС 55 уд/мин. Перикард ушит над аортой. Ушивание грудной клетки с оставлением дренажей в полости перикарда и переднем средостении. Асептическая повязка. Время пережатия аорты составило – 52 мин, время искусственного кровообращения – 112 мин.

Рисунок 5.Криоаблация основания ушка левого предсердия.

Рисунок 6.Криоаблация левых легочных вен с переходом на заднюю стенку левого предсердия.
Послеоперационный период протекал без осложнений. Пациентк, на фоне стабильной гемодинамики и хорошего газообмена, экстубирован через 10 часов после операции и переведен в отделение. Дальнейшее лечение было направлено на подбор адекватной медикаментозной терапии (антибиотики, мочегонные средства, препараты калия). За время госпитализации ритм оценивался по данным холтеровского мониторирования ЭКГ — отмечены два кратковременных срыва ритма в ФП, которые были купированы внутривенным введением новокаинамида. Продолжен прием соталекса, отменен дигоксин, к терапии добавлен аллапинин.
По результатам эхокардиографии после операции, отмечено удовлетворительная сократительная способности левого желудочка: ФВ ЛЖ составила 55%. Жидкости в полости перикарда нет. На митральном и трикуспидальном клапане недостаточности нет.
Рана зажила первичным натяжением. На 15-е сутки после операции пациент выписан в удовлетворительном состоянии под наблюдение кардиолога по месту жительства.
Через 6 месяцев после операции планово выполнено холтеровское мониторирование ЭКГ. Средняя ЧСС составила 55 уд/мин. Базовый ритм — синусовый. Куплетов, бигеминии, тригеминии, сливных комплексов и эпизодов ЖТ не зарегистрировано. Суправентрикулярная эктопическая активность представлена 375 предсердными экстрасистолами. Не было зарегистрировано пауз, пропущенных комплексов, эпизодов брадикардии и эпизодов пароксизмальной суправентрикулярной тахикардии.
Данный клинический случай подтверждает высокую эффективность современных методов хирургического лечения ФП. Необходимо отметить, что у большинства пациентов с длительно существующей ФП, отмечается расширение фиброзных колец как митрального, так и трикуспидального клапанов, с развитием их относительной недостаточности. В данном случае методом выбора является пластика клапанов в сочетании с хирургической аблацией.
На сегодняшний день, не вызывает сомнения преимущества холодовой аблации для хирургического лечения ФП над методами гипертермической аблации. Как показывают первоначальные результаты, с помощью гибкого металлического наконечника для криоаблации возможно воспроизводить линии электрической изоляции в миокарде предсердий быстро, безопасно и эффективно.
В заключение можно сказать, что Криоаблация занимает большую историю в области хирургического лечении нарушений сердечного ритма. Более того, она является интегральным компонентом классической операции «лабиринт III» [9]. Криоаблация обладает определенными преимуществами над методами гипертермической аблации в лечении ФП. При ее использовании не описаны случаи коллатерального повреждения, быстро достигается трансмуральность, а линия аблации не аритмогенна. Важно отметить, что линия изоляции характеризуется четко ограниченной зоной некроза, с наличием в нем коллагеновых волокон, что отличает ее от гипертермических линий аблации, когда появляется нежизнеспособный рубец ткани в миокарде [15].
Для получения более достоверных результатов необходимо продолжение исследования в виде увеличения количества операций, а также скрупулезный сбор и оценка информации в отдаленный период наблюдения. Основные вопросы, которые следует изучить после операции это функциональное состояние предсердий, необходимость в длительном использовании антиаритмических препаратов и антикоагулянтов.
Не всегда пациенты, у которых диагностирована мерцательная аритмия, добиваются выздоровления при помощи медикаментозной терапии. В случае ее низкой эффективности больным назначают хирургическое вмешательство. Существует несколько видов операций при мерцательной аритмии, которые способствуют улучшению состояния человека.
Какие операции делают при аритмии

Хирургическое лечение, применяемое в случае мерцательной аритмии, осуществляется различными методами, такими как радиочастотная абляция, имплантация кардиостимулятора и «лабиринт»
Современная хирургия предлагает несколько видов операций, которые решают такую проблему, как фибрилляция сердца. Данные процедуры назначают исключительно пациентам, на которых не действуют консервативные методы терапии.
Имплантация кардиостимулятора
Мерцательная аритмия лечится путем имплантации кардиостимулятора. После операции пациент чувствует значительное улучшение своего состояния. Данный эффект сохраняется в течение длительного периода времени. В будущем может потребоваться замена установленного аппарата.
Корпус кардиостимулятора устанавливают под подкожную жировую клетчатку в области груди. При помощи специальных электродов аппарат взаимодействует с миокардом и заставляет его выдавать правильный ритм.
Данная разновидность операции при мерцательной аритмии является противопоказанной при таких состояниях:
- Инфекционные заболевания острого характера.
- Обострение хронических патологий.
- Психические заболевания, которое не позволяют врачу адекватно контактировать с больным.
Эти противопоказания обычно являются временными. Как только пациенту удастся избавиться от них, врач сможет назначить ему день операции.
Перед оперативным вмешательством больной должен пройти ряд подготовительных процедур. В обязательном порядке следует сделать ЭКГ и провести суточное мониторирование АД. Не менее значимыми являются: ЭхоКГ, анализы крови и мочи.
Дополнительно требуется осмотр у врачей разных специализаций, которые могут исключить наличие у пациента явных противопоказаний к проведению операции в ближайшее время.
Проведение оперативного вмешательства состоит из нескольких последовательных этапов:
- В первую очередь пациента доставляют в операционную. Здесь ему делают местное обезболивание требуемого участка.
- Теперь хирург делает небольшой надрез кожи под левой ключицей. Разрезается подключичная вена. После в нее вводят проводник и электрод. Движение данного элемента можно отслеживать при помощи рентгена.
- Кончик электрода попадает в полость правого предсердия. Врач находит наиболее удачное место, в котором наблюдались требуемые режимы стимуляции миокарда.
- После нахождения подходящего места происходит установка и фиксация электрода.
- Как только данный этап будет проведен, хирург приступает к подшиванию титанового корпуса к полости грудной мышцы с левой стороны.
По завершении операции зашивают образовавшуюся рану и накладывают стерильную повязку.
Хирургическое вмешательство, целью которого является установка кардиостимулятора, в среднем длится около 2-3 часов. Особый дискомфорт при этом пациентом не ощущается. По окончании радикального лечения проводится настройка программного устройства.
Несколько дней после проведенной операции пациент должен находиться в стационаре, чтобы врач мог наблюдать за его состоянием. В случае отсутствия отклонений он может продолжить проходить реабилитацию уже в домашних условиях.
Окончательная стоимость имплантации кардиостимулятора зависит от нескольких факторов. В среднем за проведение лечебной процедуры человеку нужно заплатить от 100 до 200 тысяч рублей.
Радиочастотная абляция АВ-узла

Пить и есть нельзя за 4 часа до запланированной операции
Сердечная патология может привести к серьезным осложнениям. Предупредить их развитие помогает операция при мерцательной аритмии сердца. Нередко при таком диагнозе назначается радиочастотная абляция АВ-узла. В процессе лечения проводится стимуляция правого желудочка.
Радиочастотная абляция показана не всем пациентам, которые страдают от мерцательной аритмии. Данный вариант лечения является абсолютно противопоказанным для лиц, у которых имеются тромбы в полости сердца. Хирургическое вмешательство также не рекомендовано беременным женщинам, так как процедура может нанести вред здоровью плода.
Успешность хирургического вмешательства напрямую зависит от правильности проведенной к нему подготовки. За несколько суток до лечения необходимо отказаться от приема лекарственных препаратов. Пить и есть нельзя за 4 часа до запланированной операции.
Процедуру делают под общей или местной анестезией. Суть операции заключается в проведении через крупные сосуды тонких катетеров-электродов. При этом ведется флюороскопическое наблюдение за каждым действием врача.
В полости сердца в ходе операции устанавливается лечебный катетер. На его окончание подается высокочастотный ток, который отличается разрушительным действием на аритмогенный субстрат.
По завершении операции хирург проводит повторное исследование органа и системы, работа которой нарушается аритмией. Если симптомы болезни сохраняются, то врач выполняет еще несколько радиочастотных воздействий. В среднем такая процедура занимает от 30 минут до 4 часов.
Радиочастотная абляция при мерцательной аритмии обходится пациенту в сумму от 30 тысяч рублей.
Катетерная абляция

Катетерная абляция на сегодня самая высокоэффективная методика, больше 90% больных с различными формами аритмии после разрушения патологических очагов перестают ощущать приступы нарушения ритма
Радиочастотная абляция, предусматривающая проведение катетерного способа лечения, помогает провести удаление очага болезни путем его разрушения. Хирургическое вмешательство по типу РЧА при мерцательной аритмии осуществляется при участии особых катетеров. Стоимость такой операции будет указана ниже.
Для разрушения источника мерцательной аритмии используются разные варианты воздействия. Как правило, применяется способ уничтожения тканей путем влияния на них ультразвуком или лазером. Высокочастотная электрическая энергия тоже эффективна при таком нарушении.
Катетерный вариант абляции запрещен пациентам с такими противопоказаниями:
- Гипертонический криз.
- Болезни легких.
- Высокая температура тела.
- Плохая свертываемость крови.
- Почечная недостаточность.
До начала лечения пациент должен пройти полноценное диагностическое обследование, благодаря которому можно выявить имеющиеся противопоказания к проведению оперативного вмешательства. В обязательно порядке нужно сдавать анализы крови и мочи, проверять сердечный ритм и текущее состояние сердца. Дополнительно требуется обследование сердечника на стрессоустойчивость.
Перед операцией больному дают седативный препарат. Он помогает полноценно расслабиться и забыть о волнениях. После проводится местная анестезия. Ее делают в том месте, где будет осуществляться прокол кожного покрова.
Стоимость лечения данным методом зависит от степени сложности оперативного вмешательства. Расценки на процедуру в клиниках начинаются от 19 800 рублей.
Метод “Лабиринт”

Перед оперативным вмешательством пациент должен пройти ряд обязательных подготовительных процедур на предмет противопоказаний
Операция, названная «Лабиринт», является наиболее востребованной и эффективной при мерцательной аритмии. С ее помощью удается избавиться от факторов, которые приводят к развитию заболевания.
Существует несколько видов операции «Лабиринт». Каждая новая версия процедуры решает проблемы, которые возникали по завершении прошлого варианта лечебного мероприятия.
Как уже говорилось ранее, операция по типу «Лабиринт» за время своего существования прошла множество модификаций. Благодаря ее изменению удалось решить проблему выявления дисфункции синусного узла и задержки внутрипредсердной проводимости.
Третий вариант лечения сочетает в себе все имеющиеся преимущества прошлых версий. К тому же он достаточно прост в проведении.
Аритмические процедуры, включая прижигание проблемного участка, показаны пациентам, у которых были выявлены следующие патологические процессы:
- Фибрилляция предсердий, при которой отсутствуют структурные патологии сердца.
- Неэффективность медикаментозной терапии.
- Нарушение ритма симптомной формы.
- Отсутствие результата после проведения чрескожной абляции.
Необходимо помнить о том, что операция данного типа имеет ряд противопоказаний. Она не подходит пациентам при наличии таких состояний:
- Внезапное увеличение размера левого предсердия.
- Легочная форма гипертензии.
- Печеночная или почечная недостаточность.
- Низкий выброс левого желудочка.
Также учитывают общие противопоказания, которые указываются перед хирургическим вмешательством на сердце.
Перед тем как отправиться на операцию, пациент должен обследоваться на предмет противопоказаний. Требуется сдача лабораторных анализов и проведение инструментальных диагностических мероприятий.
В ходе назначения операции данного вида для купирования мерцательной терапии врач может поднимать вопрос о необходимости замены терапии на основе антикоагулянтов. Также непосредственно перед самим радикальным лечением больной должен отказаться от приема антиагрегантов, если они им используются.
Пациентам с мерцательной аритмией, которым была рекомендована методика лечения «Лабиринт», интересна стоимость данной разновидности хирургического вмешательства. Средняя цена этой процедуры ограничивается 500 тысячами рублей.
Рекомендации по выбору клиники
Квалифицированные специалисты, которые работают в государственных и частных клиниках, помогают пациентам избавиться от симптоматики мерцательной аритмии. После полноценного обследования и попыток лечения болезни другими, более консервативными, методами медик предложит больному радикальный метод. Чтобы все прошло успешно, пациент должен быть уверен в профессионализме своего врача.
При выборе врача и клиники в первую очередь необходимо обращать внимание на отзывы о специалисте и медицинском учреждении. Следует удостовериться в наличии у конкретного медика лицензии на проведение подобных операций. Опыт хирурга и процент успешных процедур тоже имеют немалое значение.
Лучше всего выбрать медицинское учреждение с усредненным прайсом и хорошей репутацией. Как правило, в таких местах лечебная услуга оказывается грамотно и в соответствии с требованиями ВОЗ.
Мерцательная аритмия ( второе наименование – фибрилляция предсердий, сокращенно ФП) является сердечным заболеванием, всё чаще и чаще проявляющим себя в виде самостоятельной патологии, поражающей сердца с нормальной анатомией. Фактически – это эпидемия, вовлекающая всё новые и новые жертвы. В профессиональной медицинской литературе рисуются весьма мрачные перспективы относительно распространения ФП. Известно, что в настоящее время более 5 миллионов граждан США страдают ФП, и что к 2050 году число американцев, страдающих ФП, должно увеличиться до 12 миллионов человек, если темпы распространения ФП сохранятся на сегодняшнем уровне. 1 Не касаясь в данном разделе сложных и до конца не выясненных причин столь бурного распространения данного заболевания, отметим, что пациент с возникшей ФП приобретает три физиологических последствия ФП: 1) учащение сердечного ритма, приводящее к снижению объема крови, выбрасываемого сердцем в аорту за единицу времени, а в редких случаях приводящее к быстрому развитию опосредованной частым ритмом кардиомиопатии; 2) потеря насосной функции предсердий, что также приводит к снижению объема крови, выбрасываемого сердцем в аорту за единицу времени; 3) застой крови в несокращающихся предсердиях с риском формирования в них тромбов и последующего их отрыва в большие сосуды. 2 Возникновение ФП несет в себе пятикратный рост риска развития эмболического инсульта. 3 Таким образом, лечение ФП, в том числе хирургическое, является сверх актуальным.
В 1987 году экспериментальные исследования в Сент-Луисе ( США) под руководством Джеймса Л. Кокса привели к появлению в кардиохирургической практике операции « лабиринт», названной в дальнейшем именем Д.Кокса ( операция Cox-Maze). 4 Смысл Cox-Maze операции заключается в прерывании любых возможных кругооборотов электрического импульса в предсердиях с препятствованием вызову повторного сокращения предсердий за счет этого же электрического импульса. Таким образом операция Cox-Maze устраняет способность предсердия трепетать или фибриллировать.
На рисунке 1 представлен схематически смысл операции Cox-Maze в авторской иллюстрации доктора Д.Кокса.
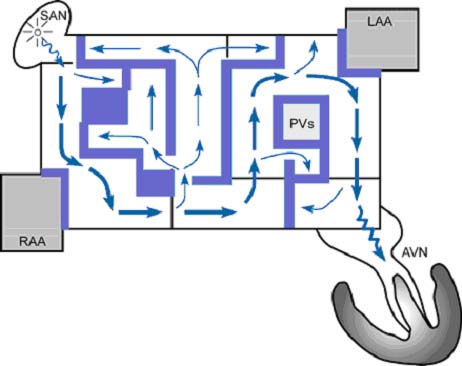
Рисунок 1. Обратите внимание, что за счет нанесенных на предсердия разрезов ( широкие синие линии) все « попытки» электрического импульса вернуться назад и вновь вызвать сокращение мускулатуры предсердий, породив трепетание или фибрилляцию предсердий, заканчиваются попаданием в тупик ( тонкие стрелки). Для этих « попыток» выход из лабиринта невозможен. Лишь один путь электрического импульса заканчивается выходом из лабиринта – это путь нормального распространения импульса от синусового узла, расположенного в предсердии, до атриовентрикулярного узла, от которого происходят сокращения желудочков сердца ( толстые стрелки). (AVN = атриовентрикулярный узел; LAA- левопредсердное ушко, PVs=легочные вены; RAA= правопредсердное ушко; SAN = синоатриальный узел).
На рисунке 2 обозначены линии создаваемых при операции Cox-Maze разрезов.
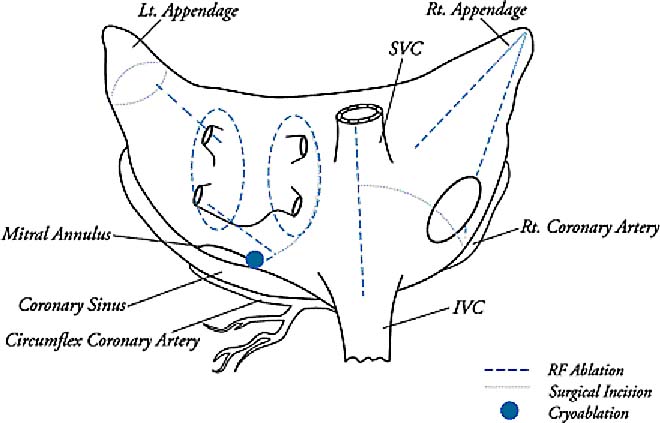
Рисунок 2. Из статьи «Surgical Treatment of Atrial Fibrillation» Rochus K. Voeller, Richard B. Schuessler, Ralph J. Damiano, Jr. в книге «Cardiac Surgery in the Adult» под редакцией Lawrence H.Cohn and L.Henry Edmubds, Jr.
Доктор Д.Кокс использовал на практике самый технологически простой способ нанесения разрезов – с помощью скальпеля и ножниц. После нанесения разрезов целостность предсердий должна быть восстановлена посредством прямого шва по линиям разрезов. Такая методика операции получила название «cut and sew», что значит « резать и сшивать».
Отдаленные результаты операции Cox-Maze в модификации «cut and sew» фантастические. На 15 лет отслеживания у 94% оперированных пациентов сохранялся синусовый ритм в условиях отсутствия приема антиаритмических препаратов! Ниже дан слайд из доклада доктора Д.Кокса, сделанного им в декабре 2012 года на конференции Dallas-Leipzig Valve.
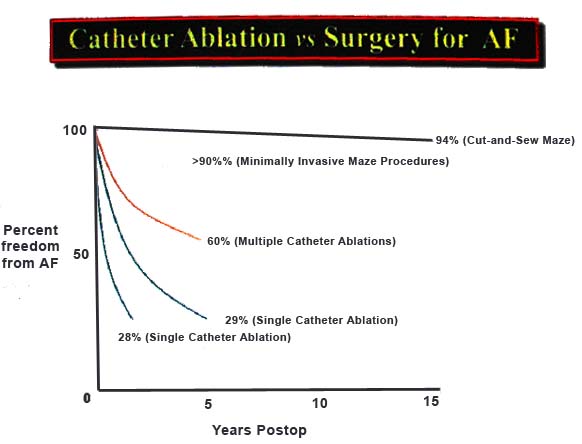
Слайд 1. Черным цветом выделена кривая, характеризующая отдаленные результаты Cox-Maze операции в модификации «cut and sew». Кривые других цветов – пятилетние результаты лечения ФП катетерными методами ( комментарии излишни!). 5
Особенностью операции Cox-Maze в модификации «cut and sew» является требуемое для ее выполнения время, выделение которого не всегда возможно при сложных кардиохирургических вмешательствах на клапанах сердца или по поводу поражений при ИБС. В связи с этим, альтернативные энергетические воздействия на предсердный миокард были разработаны взамен методики «cut and sew» 4 . Таковыми видами энергии являются крио-энергия, микроволновая, радиочастотная энергия и ультразвук. Все эти альтернативы существенно сокращают срок выполнения операции Cox-Maze, однако уступают «cut and sew» при оценке отдаленных результатов. С другой стороны, следует отметить, что все перечисленные варианты энергетического воздействия на миокард предсердий во время операции Cox-Maze, уступая «cut and sew», дают несравнимо лучший отдаленный результат в сравнении с катетерными видами лечения мерцательной аритмии ( см. слайд 1).
В ООО « Центр хирургии сердца» используются два варианта выполнения операции Cox-Maze: «cut and sew» и с помощью радиочастотной энергии. Выбор типа воздействия на миокард предсердий осуществляется в зависимости от сложности других компонентов операции и времени, необходимого для их выполнения, а также от предполагаемой степени положительного физиологического влияния результата кардиохирургической коррекции на механизмы развития фибрилляции предсердий. В случае изолированной фибрилляции предсердий операция Cox-Maze выполняется исключительно в авторской модификации «cut and sew».

Слайд 2. Доктор Джеймс Кокс во время доклада, сделанного им 5 декабря 2012 года на конференции Dallas-Leipzig Valve.
1 Lloyd-Jones D, Adams RJ, Brown TM et al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee.Heart disease and stroke statistics—2010 update: a report from the American Heart Association. Circulation 2010;121 (7 ):e46–e215.
2 Zachary J. Edgerton and James R. Edgerton. A review of current surgical treatment of patients with atrial fibrillation. Proc (Bayl Univ Med Cent) 2012;25 (3 ):218–223.
3 Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D. Impact of atrial fi brillation on the risk of death: the Framingham Heart Study. Circulation 1998;98 (10 ):946–952.
4 Rochus K. Voeller, Richard B. Schuessler, Ralph J. Damiano, Jr Surgical Treatment of Atrial Fibrillation. In the book «Cardiac Surgery in the Adult», edited by Lawrence H.Cohn and L.Henry Edmubds, Jr.
5 James Cox. The Hybrid Approach for AF: The Best of Both Worlds… Or Not! Dallas-Leipzig Valve, December, 5-7, 2012