Содержание:

—>
| Радиомагазин-73 [457] |
Войти через uID
Современные методы лечения инфекционного эндокардита
Инфекционный эндокардит (ИЭ) заболевание инфекционной природы. Возбудитель первично локализуется на клапанах сердца, пристеночном эндокарде, реже на эндотелии аорты и крупных артерий.
Заболевание регистрируется во всех странах мира и в различных климатогеографичес ких зонах. Заболеваемость по данным разных авторов составляет от 1,7 до 5,3 случая на 100 000 населения в год. Мужчины заболевают в 1,5-3 раза чаще женщин, а в возрастной группе старше 60 лет это соотношение достигает 8:1.
Средний возраст заболевших составляет 40-44 года.
В последнее время отмечается четкая тенденция к нарастанию частоты заболевания в пожилом и старческом возрасте.
Этиология ИЭ связана с различными видами возбудителей.
Наряду с зеленящим стрептококком важную роль играют золотистый и белый стафилококки, энтерококки, реже грамотрицательные микроорганизмы, патогенные грибы Aspergillus и Candida.
В отдельных случаях в качестве причинных агентов могут выступать Coxiella burnetii (возбудитель Q лихорадки), бруцеллы, легаонеллы и хламидии.
Источники инфекции. Наиболее часто определяются следующие первичные очаги: гнойные отиты, гаймориты, синуситы; болезни урогенитальной сферы (циститы, уретриты» сальпингоофориты); операции в полости рта по поводу периодонтита, тонзиллэктомия, экстракция кариозных зубов. Последняя операция сопровождается бактериемией в пределах нескольких часов у 70% пациентов. При соответствующих условиях это может привести к формированию вторичного очага в эндокарде.
Возможно развитие ИЭ после операций и инструментального обследования мочевой системы (цистоскопия, длительная катетеризация); после абортов и акушерских вмешательств, операций на желчных путях; при малых кожных инфекциях, фурункулах; длительной катетеризации вены и других.
Описаны ИЭ после пункционной биопсии печени, колоноскопии и других вмешательств.
Однако у части больных даже при тщательных выяснении анамнеза и обследовании определить входные ворота инфекции не удается.
В целом же для развития ИЭ несомненно необходимо неблагоприятное стечение обстоятельств: предшествующее поражение сердца или сосудов (при вторичном ИЭ), наличие источника инфекции, откуда бы произошел «занос» в эндокард, изменение реактивности организма, нарушение иммунитета (фоновое хроническое заболевание, хроническая алкогольная интоксикация, неблагоприятная экология и др.).
Патогенез. Первое важное звено патогенеза повреждение эндотелия сердечных клапанов и пристеночного эндокарда, обусловленные врожденной или приобретенной сердечной патологией (дефект межжелудочковой перегородки, открытый артериальный проток, ревматизм, атеросклероз, ПМК с регургитацией, кардиомиопатия, оперированное сердце) и приводящие к формированию асептических вегетации, состоящих из тромбоцитов и фибрина.
Впоследствии во время транзиторной бактериемии, возникающей после экстракции зуба, тонзиллэктомии, родов, аборта, катетеризации мочевых путей, вскрытия абсцесса и прочих вмешательств, относящихся к области малой хирургии, также без видимых причин происходит инфицирование тромбовегетаций с формированием бородавчатых разрастаний, разрушением клапанов и развитием эмболии.
В дальнейшем уже присутствующая бактериемия ведет к стимуляции гуморального и клеточного иммунитета, запуская иммунопатологические механизмы воспаления.
Большое разнообразие клинических проявлений при ИЭ обусловлено также последствиями аутосенси билизации на фоне бактериемии и измененного иммунитета.
Фиксированные на клапанах сердца микроорганизмы вызывают выработку антител, образование циркулирующих иммунных комплексов. Развиваются процессы гиперергического повреждения вторичная иммунокомплексная болезнь с васкулитами и висцеритами.
В зависимости от преимущественной локализации повреждения в клинике доминирует симптоматика гепатита, миокардита, геморрагического васкулита, иммунокомплексного гломерулонефрита.
Разнообразное поражение сердца при ИЭ (порок, миокардит с нарушениями ритма, перикардит, очаговые изменения) обусловливает закономерное развитие и нарастание сердечной недостаточности.
Поражение почек может привести к почечной недостаточности, которая может стать причиной летального исхода у 10-15% больных.
Клиническая картина ИЭ развивается, как правило, спустя 2 нед с момента возникновения бактериемии.
Одним из частых и наиболее ранних симптомов заболевания является лихорадка (в большинстве случаев неправильного типа), сопровождающаяся ознобом различной выраженности.
В то же время температура тела может быть субфебрильной (и даже нормальной) у пожилых или истощенных пациентов, при ХСН, печеночной и/или почечной недостаточности.
Характерны значительная потливость, быстрая утомляемость, прогрессирующая слабость, анорексия, быстрая потеря массы тела (до 10-15 кг).
«Периферические» симптомы ИЭ, описываемые при классической клинической картине.
в настоящее время встречаются значительно реже, в основном при длительном и тяжелом течении болезни у пожилых пациентов.
Однако геморрагические высыпания на коже, слизистых и переходной складке конъюнктивы (симптом Лукина), узелковые плотные болезненные гиперемированные образования в подкожной клетчатке пальцев кистей или на теноре ладоней (узелки Ослера), мелкие эритематозные высыпания на ладонях и подошвах (повреждения Джейнуэя), несмотря на их низкую встречаемость (от 5 до 25%) по прежнему сохраняют свою диагностическую значимость и входят в состав малых клинических критериев ИЭ.
Симптомы поражения опорно-двигательного аппарата встречаются примерно в 40% случаев, нередко являясь начальными признаками, а иногда и опережая на несколько месяцев истинную картину ИЭ.
Характерны распространенные миалгии и артралгии (реже моно- или олигоартрит) с преимущественным вовлечением плечевых, коленных и (иногда) мелких суставов кистей и стоп. Примерно в 10% случаев встречаются миозиты и тендиниты.
Возможно развитие септических артритов различной локализации. Наблюдается интенсивный болевой синдром в нижнем отделе спины, обусловленный развитием метастатического бактериального дисцита или позвонкового остеомиелита.
Основной клинический вариант заболевания эндокардит с достаточно быстрым развитием клапанной регургитации (преимущественно аортальной).
В последнее время наблюдается учащение локализации процесса на митральном, трикуспидальном клапанах и клапанах легочной артерии.
В случаях изолированного поражения трнкуспидального клапана (правосердечный эндокардит наркоманов или эндокардит при инфицировании постоянных венозных катетеров) в дебюте заболевания на первый план выступает клиническая картина двусторонней (нередко аб сцедирующей) пневмонии, плохо поддающейся лечению, а аускультативная симптоматика клапанного порока вырисовывается позднее.
Нередко развивается миокардит, проявляющийся дилатацией полостей сердца, глухостью тонов и прогрессированием НК.
Примерно у 10% больных встречается эфемерный фибринозный перикардит. В отдельных случаях при прорыве миокардиального абсцесса возможен гнойный перикардит.
Необходимо заметить, что нарастание ХСН у пожилых пациентов может быть одним из косвенных симптомов развивающегося ИЭ.
Поражение почек протекает по типу гломеру лонефрита, у части больных происходят тромбо эмболические инфаркты, у 3% (при длительном течении болезни) развивается амилоидоз.
Спленомегалия наблюдается более чем у половины больных, ее степень обычно коррелирует с длительностью болезни.
Часто выявляется увеличенная печень. У 20-40% больных отмечается поражение центральной или периферической нервной системы, обусловленное тромбоэмболией или разрывом сосудов, реже — энцефалитом и асептическим менингитом.
В отдельных случаях развиваются гнойный менингит или эмболические абсцессы мозга. Особенности течения ИЭ.
Современный ИЭ характеризуется полиэтиологичностью, обусловленной широким спектром микроорганизмов. Мировой опыт позволяет выделить определенные особенности клинической картины заболевания в зависимости от вида возбудителя.
Стрептококковый ИЭ, вызванный S.viridans, развивается преимущественно у лиц, имеющих врожденную или приобретенную сердечную патологию, чаще протекает подостро с относительно меньшей выраженностью септических проявлений и большей частотой развития иммунокомплексных синдромов (нефрит, васкулит, артрит, миокардит), в связи с чем доля ошибок в диагностике данной формы заболевания превышает 50% случаев.
ИЭ, обусловленный b-гемолитическими стрептококками, напротив, встречается значительно реже, но отличается большей остротой и агрессивностью течения, частыми эмболическими осложнениями и высокой летальностью, достигающей 40%, Энтерококковый ИЭ чаще развивается у лиц старших возрастных групп после медицинских манипуляций на урогенитальном тракте (> 70% случаев) и ЖКТ (20-27%).
Предшествующая сердечная патология отмечается примерно у 50% больных. Данной форме в большей степени свойственно подострое течение с преимущественным вовлечением в процесс левых отделов сердца (в том числе у больных наркоманией) и достаточно низкой (10%) частотой развития эмболии.
Пневмококковый ИЭ чаще встречается у больных, страдающих алкоголизмом, хроническими заболеваниями бронхолегочной системы, а также у пожилых лиц.
Протекает, как правило, остро (возможно и подострое развитие болезни), с быстро развивающейся деструкцией клапанов (чаше аортального), формированием обширных вегетации, абсцессов и системных эмболии.
Характерны отсутствие «периферических» симптомов ИЭ и высокая смертность (при задержке оперативного лечения).
Стафилококковый ИЭ, вызванный S.aureus, поражает как интактные, так и измененные сердечные клапаны (в том числе клапанные протезы). Наиболее типично острое течение с выраженными явлениями интоксикации, быстрым разрушением клапанов, множественными абсцессами различной локализации (селезенка, почки, миокард), частым поражением LLHC в виде гнойного менингита или геморрагического инсульта.
ИЭ, обусловленный коагулазонегативными стафилококками (S.epidermidis), значительно чаше развивается на клапанных протезах и несмотря на более свойственное ему подострое течение по частоте осложнений существенно не отличается от ИЭ, вызванного S.aureus.
Современное течение ИЭ.
В связи со сменой возбудителей, появлением новых групп больных (наркоманы, с протезированными клапанами) нужно отметить следующие особенности: не всегда ИЭ протекает с высокой лихорадкой; все чаще встречается митральная недостаточность, которая в сочетании с артритами при постепенном начале болезни склоняет клиницистов к диагностике ревматизма; увеличивается число больных с трехклапанной локализацией вегетации; вариант преимущественного поражения миокарда с нарушениями ритма, проводимости и нарастающей сердечной недостаточностью без клапанного поражения; чаще стала наблюдаться правосердечная локализация процесса с трикуспидальным пороком, эмболиями в систему легочной артерии.
ИЭ постарел, чаще встречается у пожилых пациентов и характеризуется стертой клинической картиной и частыми тромбоэмболиями; увеличивается число больных с первичным ИЭ, при этом лихорадка надолго опережает сердечные проявления; значительно реже встречаются классические симптомы болезни узелки Ослера, пятна Лукина-Либмана и др.
Диагностика. В современной мировой клинической практике для диагностики ИЭ применяют критерии, разработанные научно-исследовательской группой Duke Endocarditis Service из Даремского университета (США) под руководством D. Durack.
Клинические критерии ИЭ.
Большие критерии:
1. Положительная гемокультура:
а) как минимум два положительных результата исследования проб крови, взятых с интервалом не менее 12 ч;
б) три положительных результата из трех;
в) большинство положительных результатов из четырех проб крови и более (интервал между взятием первой и последней пробы должен составлять как минимум 1 ч).
2. Доказательства поражения эндокарда. Положительные данные ЭхоКГ: свежие вегетации, или абсцесс, или частичная дегисценция клапанного протеза, или вновь сформированная клапанная регургитация (нарастание или изменение имевшегося сердечного шума не учитывается).
Малые критерии:
1. Предрасположенность: кардиогенные факторы или частые внутривенные инъекции лекарств (в том числе наркомания и токсикомания).
2. Температура 38 °С и выше.
3. Сосудистые феномены: эмболии крупных артерий, инфаркт легкого, микотические аневризмы, внутричерепные кровоизлияния, геморрагии на переходной складке конъюнктивы и повреждения Джейнуэя.
4. Иммунологические феномены: гломерулонефрит, узелки Ослера, пятна Рота (овальные с бледным центром геморрагические высыпания на глазном дне) и ревматоидный фактор.
5. Микробиологические данные: положительная гемокультура, не удовлетворяющая большому критерию (исключая однократные позитивные культуры коагулазоотрицательных стафилококков, обычно эпидермального стафилококка и микроорганизмов, неявляющихся причиной ИЭ), или серологическое подтверждение активной инфекции, обусловленной потенциальным возбудителем ИЭ (Coxiella burnetii, бруцеллы, хламидии, легионеллы).
6. Эхокардиографические данные, согласующиеся с ИЭ, но не удовлетворяющие большому критерию (утолщение клапанных створок, «старые» вегетации и т. д.).
7. Основные изменения лабораторных показателей: анемия, сдвиг лейкоцитарной формулы влево при нормальном (чаще) или уменьшенном количестве лейкоцитов, тромбоцитопения, резко увеличенная СОЭ, гипопротеинемия, гипергаммаглобулинемия, появление С-реактивного белка, гиперфибриногенемия, криоглобулинемия, положительный ревматоидный фактор, высокий уровень циркулирующих иммунных комплексов, антинуклеарный фактор в низких титрах, протеинурия, гематурия.
Определенный ИЭ.
Патологические критерии: микроорганизмы, выделенные из вегетации, эмболов или миокардиальных абсцессов, или патоморфологические изменения вегетации или абсцессы миокарда, подтвержденные гистологически.
Клинические критерии: два больших критерия, или один большой и три малых критерия, или пять малых критериев.
Возможный ИЭ.
Результаты исследований согласуются с ИЭ, но для определенного ИЭ недостаточно критериев, а в отвергнутый ИЭ данные не укладываются.
Отвергнутый ИЭ. Точный альтернативный диагноз, регресс симптомов при антибиотикотерапии до 4 дней, отсутствие патоморфологических признаков ИЭ в операционном или аутопсийном материале при антибиотикотерапии до 4 дней.
Дифференциальную диагностику ИЭ у пациентов молодого и среднего возраста следует проводить с острой ревматической лихорадкой, диффузными болезнями соединительной ткани (в первую очередь с СКВ), системными васкулитами.
В группе пожилых больных наиболее частой «маской» ИЭ являются злокачественные новообразования и инфекция мочевых путей.
Лечение. Ведущий принцип лечения ИЭ ранняя, массивная и длительная (не менее 4-6 нед) антибактериальная терапия с учетом чувствительности выделенного возбудителя к антибиотикам.
Следует применять антибиотики, оказывающие бактерицидное действие. В табл. ниже представлены основные схемы антибиотикотерапии ИЭ в зависимости от наиболее часто выявляемых возбудителей.

*МИК минимальная ингибирующая концентрация
Как следует из таблицы, применение пенициллина или цефалоспоринов в качестве монотерапии целесообразно только при выявлении высокочувствительных к ним зеленящих стрептококков.
В подобной ситуации несомненно заслуживает внимания препарат цефтриаксон (лендацин, лонгацеф, роцефин) цефалоспориновый антибиотик III поколения, фармакокинетические свойства которого позволяют успешно применять его 1 раз в сут в/в.
При ИЭ иной этиологии, а также в случаях, когда возбудитель не идентифицирован, наиболее оправдана комбинация 3 лактамных и аминогликозидных антибиотиков.
Из последних наиболее часто применяют гентамицин.
В настоящее время наряду с изучением новых аминогликозидов (амикацин, нетилмицин) активно разрабатывается принципиально иная стратегия применения этих препаратов, заключающаяся в однократном введении их суточной дозы.
Имеющиеся на сегодняшний день экспериментальные и клинические данные свидетельствуют о большей эффективности и лучшей переносимости аминогликозидов при однократном их введении и несомненной перспективности исследований в этом направлении.
При непереносимости b-лактамных антибиотиков либо устойчивой к ним гемокультуре используют ванкомицин в сочетании с гентамицином.
Смену антибиотика целесообразно осуществлять только при отсутствии клинического эффекта (но не ранее чем через 5-7 дней от начала применения) или в случае возникшей в процессе лечения резистентности возбудителя к проводимой терапии.
При выраженных клинических и/или лабораторных иммунопатологических проявлениях оправдано назначение преднизолона в дозе 20-30 мг/сут.
Комбинированная терапия также проводится в случаях ИЭ, вызванного стрептококками, умеренно чувствительными к пенициллину.
При этом целесообразно повысить суточную дозу пенициллина до 30 млн ЕД.
При непереносимости пенициллина применяют цефалоспорины I (цефазолин) или III (цефтриаксон) поколения.
Следует помнить о возможности перекрестных аллергических реакций на пенициллины и цефалоспорины, которые, по данным разных авторов, встречаются в 10-15% случаев.
Комбинированная терапия двумя препаратами также проводится у больных ИЭ клапанных протезов, обусловленном Str. Viridans.
При этом лечение пенициллином или цефалоспоринами сочетают с гентамицином, который следует применять в течение как минимум 2 нед. Необходимо отметить, что длительное применение аминогликозидов (в частности, гентамицина) в высоких дозах нередко сопровождается ото- и нефротоксическим эффектом, особенно у пожилых больных.
С целью предупреждения токсического действия целесообразно мониторирование концентрации названных препаратов в сыворотке крови. Однако соблюдение этого требования не всегда возможно в условиях российских стационаров общего профиля, учитывая их недостаточную техническую оснащенность.
Поэтому с практической точки зрения может быть оправдана прерывистая схема применения гентамицина при ИЭ.
Препарат назначают в течение 7-10 дней с последующим 5-7 дневным перерывом с целью профилактики токсических эффектов, затем проводят повторные курсы в тех же дозах.
Следует подчеркнуть, что в настоящее время ведутся активное изучение возможностей применения новых аминогликозидов (амикацин, нетилмицин) в терапии ИЗ и отработка принципиально иной схемы лечения этими препаратами, заключающейся в однократном введении их суточной дозы.
Имеющиеся на сегодняшний день экспериментальные и клинические данные свидетельствуют о большей эффективности и лучшей переносимости аминогликозидов при однократном их введении и несомненной перспективности дальнейших исследований в этом направлении.
В случаях неэффективности лекарственной терапии ИЭ необходимо хирургическое лечение, основными показаниями к которому являются: некорригируемая прогрессирующая ХСН; не контролируемый антибиотиками инфекционный процесс; повторные эпизоды тромбоэмболии; абсцессы миокарда; эндокардит оперированного сердца.
Следует подчеркнуть, что активный ИЭ не считается противопоказанием к оперативному лечению.
Профилактика. В соответствии с рекомендациями Американской кардиологической ассоциации антибиотикопрофилактика ИЭ должна осуществляться у пациентов с «кардиогенными факторами риска» (врожденные и приобретенные, в том числе оперированные, пороки сердца, перенесенный ИЭ, гипертрофическая кардиомиопатия, пролапс митрального клапана) при выполнении у них различных медицинских вмешательств, которые могут сопровождаться преходящей бактериемией: экстракция зуба, тон зиллэктомия, урологические, гинекологические операции и диагностические манипуляции, иссечение и дренирование инфицированных мягких тканей и т. д.
С учетом потенциальных возбудителей ИЭ рекомендуется пероральный прием амоксициллина (3 г) или клиндамицина (300 мг), либо парентеральное введение ампициллина (2 г) в сочетании с гентамицином (80 мг), или ванкомицина (1 г) не ранее чем за 1 ч до проведения манипуляции с последующим одно или двукратным приемом тех же препаратов в течение суток в дозах, составляющих половину исходных.
Подобная методика считается достаточно обоснованной, поскольку в этих условиях обеспечивается адекватная концентрация антибиотика в сыворотке крови на время проведения манипуляции и практически устраняется возможность размножения резистентных штаммов микроорганизмов.
Проблема инфекционного эндокардита (ИЭ) актуальна во многих странах мира. Согласно данным многочисленных зарубежных исследований, заболеваемость ИЭ составляет 3–10 случаев на 100 тыс. человек в год. В течение последних десятилетий увеличилось количество и
The problem of infectious endocarditis (IE) is significant in many countries of the world. According to the data of numerous foreign studies, occurrence of IE is 3–10 cases for 100 000 people per year. During the last decades, the number of risk factors for this disease has increased, and their correlation has changed. Injective drug-addiction, cardio-surgical operations, and invasive medical manipulations (prolonged intravenous line, hemodialysis) are playing the key role now.
Проблема инфекционного эндокардита (ИЭ) актуальна во многих странах мира. Согласно данным многочисленных зарубежных исследований, заболеваемость ИЭ составляет 3–10 случаев на 100 тыс. человек в год. Несмотря на проведение современных методов диагностики, в том числе трансэзофагеальной эхокардиографии, мультиспиральной компьютерной томографии, магнитно-резонансной томографии, масс-спектрометрии и полимеразной цепной реакции, установленные алгоритмы проведения бактериологического исследования крови, использование схем рациональной антимикробной терапии (АМТ), летальность при ИЭ остается высокой, составляя более 20% [1].
В течение последних десятилетий увеличилось количество и изменилось соотношение основных факторов риска данной нозологии. Наиболее важную роль стали играть инъекционная наркомания, кардиохирургические операции и инвазивные медицинские манипуляции (длительная катетеризация вен, гемодиализ), что привело к смене ведущего возбудителя, которым в настоящее время, согласно большинству исследований, является Staphylococcus aureus [6].
В этиологической структуре ИЭ ведущую роль традиционно играют грамположительные микроорганизмы. Среди них наиболее часто выделяют Staphylococcus aureus, Streptococcus viridans, коагулазанегативный стафилококк и Enterococcus spp.
В последние годы отмечается рост резистентности большинства возбудителей ИЭ к антимикробным препаратам, применяемым в клинической практике. Распространенность резистентности может значительно различаться в разных странах и географических регионах. В случае ИЭ основную проблему представляют метициллинорезистентные штаммы стафилококков и штаммы Enterococcus spp. с высоким уровнем резистентности к аминогликозидам.
Высокие цифры смертности при ИЭ во многом обусловлены развитием потенциальных осложнений, среди которых наиболее часто отмечаются развитие и прогрессирование сердечной недостаточности, тромбоэмболические проявления, развитие инфекционных аневризм, а также поражение внутренних органов различной локализации [2].
Материалы и методы
Было проведено многоцентровое исследование этиологии, антибиотикорезистентности и фармакоэпидемиологии инфекционного эндокардита, состоящее из двух частей: проспективной (сентябрь 2011 г. — декабрь 2016 г.) и ретроспективной (январь 2006 г. — август 2011 г.).
В исследование включались пациенты обоего пола всех возрастных групп с определенным и вероятным ИЭ. Диагноз ИЭ выставлялся согласно критериям Duke. В исследование включено 406 (в проспективной части — 166, в ретроспективной — 240) случаев ИЭ.
Пациенты находились на стационарном лечении в 11 лечебных учреждениях 9 городов Российской Федерации (Архангельск, Казань, Москва, Омск, Санкт-Петербург, Смоленск, Тюмень, Якутск, Ярославль). Все стационары, принявшие участие в исследовании, имеют многопрофильный характер и располагают собственной микробиологической лабораторией.
Идентификация микроорганизмов проводилась согласно рутинной локальной практике. Определение чувствительности выделенных штаммов стафилококков и энтерококков проводилось диско-диффузионным методом.
Критериями включения в исследование были: наличие диагноза определенного или вероятного ИЭ в карте стационарного больного, факт взятия хотя бы одного образца крови для бактериологического исследования, проведенная эхокардиография, доступность медицинской документации.
В ходе исследования на каждого пациента собирались анамнестические и клинические данные, которые вносились в специально разработанные индивидуальные регистрационные карты и в дальнейшем вводились с использованием метода двойного ввода в специализированную базу данных, разработанную на основе базы управления данными Microsoft Access для Windows. Статистическая обработка данных проводилась с помощью статистического пакета SAS Institute, США, версия 8.02 для Windows XP.
Результаты исследования
В настоящее время диагностика ИЭ базируется на общепризнанных Duke-критериях, в которых выделяют большие и малые критерии [7, 8].
В структуре больших критериев ИЭ в общем выделение этиологически значимых возбудителей при бактериологическом исследовании крови отмечалось в 35,5%, эхокардиографические признаки поражения эндокарда в 99,5%. В проспективном исследовании аналогичные показатели составили — 31,5% и 100,0%, в ретроспективном исследовании — 38,1% и 99,2% соответственно.
В структуре малых критериев ИЭ в общем иммунные проявления отмечались в 11,1%, лихорадка в 93,8%, микробиологические признаки, не соответствующие основному критерию, — в 2,2%, предрасполагающие факторы поражения сердца и инъекционная наркомания — в 77,3%, сосудистые проявления — в 38,2%. В проспективном исследовании аналогичные показатели составили — 9,6%, 96,4%, 4,2%, 77,1%, 33,1%, в ретроспективном исследовании — 12,1%, 92,1%, 0,8%, 77,5%, 41,7% соответственно.
Факторы риска в значительной степени определяют структуру возбудителей ИЭ и имеют важное значение в диагностике.
В общей структуре исследования среди факторов риска ИЭ в большинстве случаев отмечались: инъекционная наркомания — 39,2%, приобретенный порок сердца — 33,2%, ранее перенесенный ИЭ — 18,3% (рис. 1).
.gif)
В проспективной части исследования среди факторов риска наиболее часто отмечались приобретенный порок сердца — 36,1%, инъекционная наркомания — 30,4%, ранее перенесенная операция на сердце — 19,4%, ранее перенесенный ИЭ — 18,8%.
В ретроспективном исследовании среди факторов риска наиболее часто отмечались инъекционная наркомания — 42,7%, приобретенный порок сердца — 31,3%, ранее перенесенный ИЭ — 18,0%.
Бактериологическое исследование крови проводилось многократно в 52,7% случаев, однократно в 47,3%. Наиболее существенным аспектом данного исследования является необходимость его проведения до назначения АМТ. Согласно полученным данным, своевременность проведения бактериологического исследования крови отмечена в 20,9%, в проспективном исследовании только в 19,3%, в ретроспективном — в 22,1%.
Среди визуализирующих методов диагностики наибольшее значение имеет эхокардиография, позволяющая в большинстве случаев выявить патологические изменения на клапанном аппарате сердце [10].
При проведении эхокардиографии в общей структуре исследования в 84,2% использовалась только трансторакальная эхокардиография, только трансэзофагеальная эхокардиография в 3,7%, сочетание трансторакальной и трансэзофагеальной эхокардиографии в 12,1%. В проспективном исследовании аналогичные показатели составили — 75,3%, 4,8%, 19,9%, в ретроспективном исследовании — 90,4%, 2,9% и 6,7%.
Наиболее частой локализацией поражения в общей структуре исследования был митральный клапан — 43,6%, аортальный клапан поражался в 37,9%, трехстворчатый клапан в 34,7%, клапан легочной артерии в 0,5% случаев. В проспективной части исследования наиболее часто поражался митральный клапан — 44,6%, аортальный клапан поражался в 39,8%, трехстворчатый клапан в 34,3%, клапан легочной артерии в 0,6%. В ретроспективной части исследования наиболее часто поражался митральный клапан — 42,9%, аортальный клапан поражался в 36,7%, трехстворчатый в 35%, клапан легочной артерии в 0,4% случаев.
Этиотропная направленность АМТ пациентов с ИЭ подробно освещена в современных зарубежных рекомендациях и играет ключевую роль при выборе наиболее корректного лечения [3]. С учетом этого обстоятельства была проведена микробиологическая идентификация включенных в исследование случаев.
В общей структуре исследования из 406 случаев в 144 (35,5%) был выделен этиологически значимый возбудитель. Преобладали грамположительные микроорганизмы — 130 (90,3%), а среди них — Staphylococcus aureus (46,5% от всех выделенных возбудителей) (рис. 2).
.gif)
В течение последних десятилетий отмечается глобальный рост антибиотикорезистентности среди возбудителей большинства инфекций, во многом предопределяющий эффективность АМТ [9, 11].
В общей структуре проведенного исследования из 67 идентифицированных штаммов Staphylococcus aureus 19 (28,4%) являлись метициллинорезистентными. Из 23 штаммов коагулазанегативного стафилококка 8 (34,8%) являлись метициллинорезистентными. Среди выделенных 23 штаммов Enterococcus spp. преобладали 13 (56,5%), резистентные к гентамицину.
Обсуждение результатов исследования
Значимость проблемы ИЭ подтверждается отсутствием тенденции к снижению заболеваемости и смертности при данной патологии [5].
Улучшение ведения пациентов с ИЭ невозможно без знания особенностей диагностики и терапии, четких представлений об этиологической структуре, учета глобальных и локальных данных об антимикробной резистентности наиболее часто встречающихся возбудителей. В этой связи чрезвычайно важной представляется совместная эффективная работа клинических микробиологических лабораторий с целью получения достоверных данных о возбудителях и их чувствительности к антимикробным препаратам и врачей, занимающихся лечением пациентов с ИЭ. Одним из способов получения подобной информации является участие в многоцентровых исследованиях, проводимых по единому протоколу.
Современная диагностика ИЭ основывается на предложенных в 1994 г. и впоследствии дополненных Duke-критериях, согласно которым ключевая роль в диагностике ИЭ отводится бактериологическому исследованию крови и визуализирующим методам диагностики [7, 8].
Наиболее часто используемым из визуализирующих методов диагностики ИЭ является эхокардиография, проведение которой позволяет определить локализацию поражения, размеры микробных вегетаций, степень и динамику компенсации поврежденного клапана, что в свою очередь определяет дальнейшую тактику ведения пациентов с ИЭ [10]. Согласно проведенному исследованию, в 84,2% использовалась исключительно трансторакальная эхокардиография, информативность которой по сравнению с трансэзофагеальной существенно ниже. Это обуславливает необходимость оптимизации диагностического процесса пациентов с ИЭ.
В последние годы увеличилось количество публикаций, свидетельствующих о потенциальной роли в диагностике инфекционного поражения эндокарда компьютерной томографии и магнитно-резонансной томографии. При этом следует отметить, что на сегодняшний день данные методы исследования не вошли в рутинную практику и их применение при ИЭ в основном ограничено диагностикой тромбоэмболических осложнений, а также поиском истинного диагноза при лихорадке неясного генеза [3].
В ходе проведения настоящего исследования наиболее частой локализацией инфекционного поражения был митральный клапан (43,6%). Это согласуется с данными большинства современных исследований. Следует также отметить достаточно высокие цифры поражения трехстворчатого клапана (34,7%), что можно объяснить высокой частотой инъекционной наркомании и других факторов риска (катетеризация центральных вен, инвазивные манипуляции на крупных сосудах и сердце), способствующих повреждению данного клапана [2].
Характеризуя результаты бактериологического исследования крови в данном исследовании, следует отметить достаточно низкий уровень выделения этиологически значимых возбудителей. В настоящем исследовании этиология установлена в 35,5%. Ключевое значение в данной ситуации имеет тот факт, что в подавляющем большинстве случаев, согласно проведенному исследованию — в 79,1%, взятие образцов крови происходило после назначения АМТ.
В структуре факторов риска проведенного исследования преобладали инъекционная наркомания и приобретенный порок сердца, 39,2% и 33,2% соответственно. Это подтверждается современными зарубежными данными, согласно которым имеет место тенденция к увеличению числа случаев ИЭ, развивающихся на фоне инъекционной наркомании и применения диагностических инвазивных манипуляций на сердце и крупных сосудах, а также случаев вторичного ИЭ [11].
В качестве возбудителей ИЭ может выступать довольно значительное количество микроорганизмов, большинство из которых являются грамположительными бактериями. Это находит четкое подтверждение в современных исследованиях ИЭ [2].
Вместе с тем за последние десятилетия в этиологической структуре ИЭ произошли существенные изменения. Основным из таких изменений является то, что ведущим возбудителем стал Staphylococcus aureus, вместо Streptococcus viridans. Данная тенденция наблюдается в большинстве стран, в том числе и в Российской Федерации. Согласно данным проведенного исследования, частота выделения Staphylococcus aureus и Streptococcus viridans составила 46,5% и 11,8% соответственно. Это в свою очередь объясняется изменениями в соотношении факторов риска данной патологии. Среди них первостепенное значение в настоящее время играют инъекционная наркомания, инвазивные диагностические и лечебные манипуляции на сердце и крупных сосудах, в то время как стоматологические манипуляции и плохая гигиена полости рта играют второстепенное значение [6].
Следует также отметить, что изменения в этиологической структуре ИЭ и ведущее значение Staphylococcus aureus среди возбудителей в значительной степени объясняют и высокие цифры летальности при ИЭ. Ввиду того что Staphylococcus aureus продуцирует токсины, вызывающие изменения в свертывающей системе крови, в настоящее время имеет место значительное количество тромбоэмболических осложнений у пациентов с ИЭ [2].
Обращает на себя внимание увеличение доли штаммов MRSA как в общей структуре инфекционной патологии, так и при ИЭ. Согласно настоящему исследованию, среди всех случаев выделения Staphylococcus aureus в 28,4% были выделены штаммы MRSA. При этом доля MRSA в проспективном исследовании составила 40%, в ретроспективном — 18,9%. К сожалению, ограниченность выборки не позволила получить статистически достоверные различия. Вместе с тем тенденция нарастания метициллинорезистентности Staphylococcus aureus вызывает серьезные опасения в связи с тем, что при бактериемии, вызванной MRSA, имеет место снижение активности одного из ключевых препаратов при терапии ИЭ — ванкомицина.
В подтверждение важности данной проблемы служит тот факт, что, согласно многочисленным литературным данным, в частности метаанализу, включившему 31 научное исследование с общим количеством случаев бактериемии, вызванной Staphylococcus aureus, 3963, смертность при бактериемии, вызванной MRSA, существенно выше, по сравнению с бактериемией, вызванной MSSA (p = 0,007) [9].
Наряду с увеличением роли Staphylococcus aureus при ИЭ, имеет место тенденция и к увеличению выделения Enterococcus spp. Вероятной причиной этого служит высокая частота патологии органов брюшной полости и малого таза и, как следствие, то, что на сегодняшний день Enterococcus spp. является одним из основных возбудителей амбулаторных и нозокомиальных случаев бактериемии. В проведенном исследовании доля выделенных штаммов Enterococcus spp. составила 16,0%. Наметившийся рост количества случаев ИЭ, вызванного энтерококками, вызывает озабоченность, обусловленную тем, что данные микроорганизмы обладают дефектной системой аутолиза, способствующей потенциальному развитию рецидивов.
Увеличение количества потенциальных факторов риска привело к тому, что в течение последних десятилетий в этиологической структуре ИЭ представлены грамотрицательные микроорганизмы, частота выделения которых в большинстве случаев составляет 6–10%. Это подтверждается результатами и настоящего исследования, согласно которому доля грамотрицательных бактерий в этиологической структуре ИЭ составила 9,7%. Существенное внимание уделяется группе медленно растущих, требующих особых условий культивирования грамотрицательных палочек, объединяемых аббревиатурой НАСЕК и являющихся представителями микробиоты ротовой полости. Несмотря на то, что, согласно подавляющему количеству исследований, грамотрицательные бактерии в настоящее время не являются ведущими возбудителями ИЭ, необходимо учитывать вероятность данных микроорганизмов в этиологии ИЭ при соответствующих факторов риска ввиду того, что в данных случаях (за исключением бактерий группы HACEK) режимы терапии ИЭ будет носить принципиально иной характер [2, 11].
В заключение следует отметить, что для обеспечения высокоэффективных мер контроля ИЭ прежде всего необходимо знать особенности структуры факторов риска и возбудителей данной нозологии и осуществлять регулярный мониторинг за динамикой их резистентности к антимикробным препаратам. Знание этих показателей позволит не только более эффективно бороться с ИЭ, но и оптимизировать АМТ, что, в свою очередь, позволит повысить эффективность лечения больных и снизить экономические потери медицинских учреждений. Вместе с тем до сих пор в Российской Федерации недостаточно данных, характеризующих проблемы диагностики и терапии ИЭ. Ориентироваться только на данные зарубежных исследований нельзя, в связи с потенциальными различиями в структуре факторов риска и политике применения антимикробных препаратов в Российской Федерации и за рубежом.
Выводы
- Учитывая низкий уровень определения этиологически значимых возбудителей при ИЭ в Российской Федерации, расшифровка факторов риска (определение потенциальных возбудителей) данной нозологии имеет важное значение.
- В структуре факторов риска ИЭ в Российской Федерации преобладают инъекционная наркомания и приобретенный порок сердца.
- Наиболее частым возбудителем ИЭ в Российской Федерации является Staphylococcus aureus.
- Для подбора оптимальных режимов эмпирической и этиотропной терапии крайне важно продолжить дальнейшее изучение структуры факторов риска и этиологии ИЭ.
Литература
- Данилов А. И., Кречикова О. И. A. actinomycetemcomitans: клиническое значение, диагностика, антимикробная терапия // Клиническая микробиология и антимикробная химиотерапия. 2012; 14 (4): 276–279.
- Данилов А. И., Козлов Р. С., Козлов С. Н., Дехнич А. В. Практика ведения пациентов с инфекционным эндокардитом в Российской Федерации // Антибиотики и химиотерапия. 2017; 62 (1–2): 7–11.
- Данилов А. И., Козлов С. Н., Евсеев А. В. Обновленные рекомендации Европейского общества кардиологов по ведению пациентов с инфекционным эндокардитом // Вестник Смоленской государственной медицинской академии. 2017; 16 (1): 63–69.
- Дехнич А. В., Данилов А. И. Даптомицин: обзор фармакологических, клинических и микробиологических параметров // Клиническая микробиология и антимикробная химиотерапия. 2010; 12 (4): 295–313.
- Моисеев В. С., Котова Е. О., Караулова Ю. Л. Эпидемиология и клиническое течение современного инфекционного эндокардита (по данным муниципальной больницы) // Клиническая фармакология и терапия. 2014; 23 (3): 62–66.
- Чипигина Н. С., Белостоцкий А. В. Инфекционный эндокардит: изменение предрасполагающих факторов и эволюция возбудителей // Сердце: журнал для практикующих врачей. 2010; 9 (4): 242–250.
- Durack D., Lukes D. K., Briqht D. K. et al. New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Duke Endocarditis Service // American Journal of Medicine. 1994; 96 (3): 200–209.
- Li J., Sexton D. J., Mick N. et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis // Clinical Infectious Disease. 2000; 30 (4): 633–638.
- Taylor A. Methicillin-resistant Staphylococcus aureus infections // Primary Care. 2013; 40 (3): 637–654.
- Wonq D., Keynan Y., Rubinstein E. Comparison between transthoracic and transesophageal echocardiography in screening for infective endocarditis in patients with Staphylococcus aureus bacteremia // European Journal of Clinical Microbiology and Infectious Diseases. 2014; 33 (11): 2053–2059.
- Yew H., Murdoch D. Global trends in infective endocarditis epidemiology // Current Infectious Disease Reports. 2012; 14 (4): 367–372.
А. И. Данилов 1
Т. А. Осипенкова
Р. С. Козлов, доктор медицинских наук, профессор, член-корреспондент РАН
ФГБОУ ВО СГМУ МЗ РФ, Смоленск
Современные особенности инфекционного эндокардита в Российской Федерации/ А. И. Данилов, Т. А. Осипенкова, Р. С. Козлов
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 54-57
Теги: сердце, инфекции, факторы риска
Медицинский портал о здоровье и красоте
Сегодня более 50% случаев смертей в России происходят от болезней сердца. Одной из самых тяжелых патологий является эндокардит, который имеет печальный прогноз: без лечения больной погибает через 1-1,5 месяца. Чем раньше человек пройдет диагностику и начнет терапию, тем выше шансы выжить и сохранить высокое качество жизни.
Что такое инфекционный эндокардит
Болезнь связана с воспалением внутренней оболочки сердца, которая состоит из клеток эпителия и покрывает поверхности всех камер. Поражаются эндотелий и клапанный аппарат. Патология развивается на фоне инфекции. Другое ее название – бактериальный или септический эндокардит. Заболевание снижает качество жизни, опасно летальным исходом. Мужчины болеют в 2-3 раза чаще женщин. В группе риска находятся дети с пороками сердца.
Виды и формы
При формулировке диагноза указывают типы патологии по нескольким категориям. В классификации по причине появления эндокардит делится на 2 типа:
- Первичный – развивается в здоровом сердце при септическом состоянии. Редкая форма эндокардита, поскольку бактериальная флора не поврежденным тканям не опасна.
- Вторичный – возникает у пациентов с имеющимся поражением клапанов.
По клинической картине инфекционное воспаление эндокарда имеет 3 вида:
- Активный – развивается на фоне заражения стафилококком, имеет ярко выраженные симптомы.
- Излеченный (неактивный) – возникает у лиц с ревматизмом сердца, красной волчанкой, имеет стертые септические проявления или полностью их лишен.

По клиническому течению болезни выделяют 3 формы эндокардита:
- Острая – длится до 8 недель, имеет ярко выраженные септические симптомы, часто возникает при заражении крови стафилококком. Развитие болезни быстрое, осложнения появляются рано, патология опасна для жизни.
- Подострая – развивается у пациентов с 9-й недели, если острый эндокардит (или его причина) не получил достаточного лечения. В этой форме болезнь длится до 1,5 лет.
- Хроническая (затяжная) – возникает при изменении структуры или работы клапана сердца, у 85% пациентов есть первичный дефект. Патология в такой форме наблюдается в 40% случаев эндокардита инфекционного происхождения, свойственна детям до года, наркоманам.
По характеру изменения клапанов сердца патология делится на такие виды:
- Диффузный – эндотелий здоровый, шансы на полное излечение пациента высокие. Створки клапана утолщены, на поверхности возникают гранулемы.
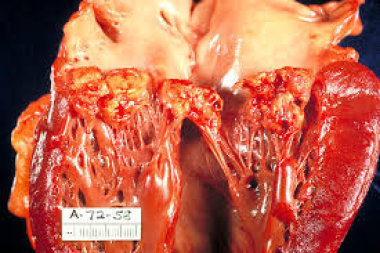
- Острый язвенный – в створках появляются аневризмы, прободения, через которые выпадают тромботические массы. Клапаны расплавлены, на них находятся колонии бактерий. Края створок имеют некротические изменения.
- Полипозно-язвенный – затяжная септическая форма болезни, при которой деструкция тканей возникает на склерозированных клапанах. Здоровые затронуты редко.
- Фиброзный – не часто встречающийся вид эндокардита инфекционного происхождения, имеет продуктивное воспаление, деформацию клапана и приводит к пороку сердца.
По наличию осложнений септический эндокардит делят на 2 формы:
- Изолированная (не осложненная) – воспалительный процесс протекает на 1 участке.
- Осложненная – инфекционные агенты распространяются за пределы сердца, затрагивают соседние с пораженным клапаны, головной мозг.

Этиология
Подострое инфекционное воспаление эндокарда часто вызывают зеленящие стрептококки, острое – золотистый стафилококк (Staphylococcus aureus). Реже к болезни приводят такие бактерии:
- энтерококк – становится патогенным под влиянием факторов риска, вызывает бактериальный эндокардит в 10-15% случаев;
- пневмококк – поражает эндокард у детей, которые не получили полноценное лечение менингита, пневмонии;
- бактерии группы НАСЕК (гемофильная палочка, кингелла) – плохо поддаются диагностике, поражают эндокард в 3-7% случаев;
- коксиелла – инфекцию передают больные животные, вызывают симптомы пневмонии, поражают печень, редко затрагивают эндокард;
- шигелла, сальмонелла – приводят к воспалению сердца с вероятностью 5-14%.
Инфекционное воспаление, кроме бактериальной флоры, вызывают грибы и вирусы:
Патогенез инфекционного эндокардита
Болезнь развивается на участках поврежденных тканей оболочки сердца. В этой зоне формируется сгусток крови из тромбоцитов, который после заражают бактерии. Появляется вегетация из фибрина, лейкоцитов, патогенных организмов. Реже бактерии повреждают клапаны напрямую – так в эндокарде возникают абсцессы и другие дефекты. При появлении вегетаций развиваются такие механизмы патологии:
- При постоянном поступлении возбудителя в кровоток возникают интоксикация и анемия.
- По мере увеличения вегетаций нарушается работа клапанов и изменяются соседние ткани.
- Части вегетаций расходятся с кровью по организму, закупоривают просвет сосуда, формируют гнойный очаг.
- В крови появляются комплексы из антигенов и иммуноглобулинов, которые вызывают осложнения: артрит, нефрит, воспаление миокарда.
Провоцирующие факторы
Подострая форма эндокардита часто развивается на фоне таких патологий:
- врожденный или приобретенный порок сердца (пролапс митрального клапана, дефект перегородки);
- ревматическое поражение клапанов.
Риск появления бактериального эндокардита повышается под влиянием таких факторов:
- частый гемодиализ (очищение крови);
- иммунодефицит (у лиц с положительным ВИЧ-статусом, наркоманов);
- механические и биологические протезы клапанов;
- сифилис;
- кардиостимуляторы, венозные катетеры;
- хронические инфекционные очаги;
- обструктивная кардиомиопатия;
- имплантация протеза сосуда;
- операции на сердце.

Симптомы эндокардита
Клиническая картина болезни зависит от возбудителя, возраста больного, вида патологии.
У грудных детей эндокардит часто протекает в хронической форме и связан с пороками сердца.
Если патология развивается на здоровом сердце, у нее быстрое и внезапное начало. Главные симптомы первичного эндокардита:
- лихорадка (у детей температура поднимается до 40 градусов, у взрослых – до 39);
- интоксикация (рвота, тошнота, слабость, разбитость).
Вторичная патология развивается медленно, ведущим в клинической картине является общеинфекционный синдром:
- постепенно растущая температура (37-38 градусов);
- утомляемость;
- боли в мышцах;
- потеря работоспособности.
У 30% больных при высокой температуре появляется озноб, а при низкой – ночью усиливается потоотделение. У пожилых, детей и лиц с ВИЧ-статусом симптомы эндокардита часто стертые, основной признак болезни – лихорадка. Появляются боли в суставах, снижается масса тела.

Изменение внешнего вида
При хроническом течении эндокардита больной становится бледным на фоне анемии. Если поражена печень, кожа и слизистые приобретают желтый оттенок. Часто возникает сыпь, которая имеет такие особенности:
- пятна мелкие, красного цвета;
- при надавливании сыпь бледнеет;
- зуд и боль отсутствуют;
- локализуются высыпания на передней поверхности тела.
У детей часто снижается масса тела, замедляется физическое развитие. Другие симптомы болезни, по которым можно провести диагностику воспаления эндокарда самостоятельно:
- Узелки Ослера – круглые красные или пурпурные образования на стопах и ладонях, болезненные при прикосновении. Появляются в подострой стадии заболевания и при хроническом его течении, исчезают без лечения через несколько дней.
- Снижение подвижности суставов, отечность.
- Симптом Лукина-Либмана – высыпания с белой точкой по центру, локализуются на нижней конъюнктиве.
- Утолщение пальцев (форма барабанных палочек).
- Потемнение ногтевой пластины.
- Шелушение кожи, ломкость волос.
- Пятна Рота – кровоизлияния на сетчатке, которые имеют светлый центр. Симптом подострой формы патологии.
- Пятна Джейнуэя – располагаются на ладонях и стопах, выглядят как рельефные красные точки.
- Симптом щипка – при захвате кожи на конечности появляется мелкое кровоизлияние, которое говорит о повышенной хрупкости капилляров.
Поражение сердца
За 2-3 месяца с начала инфекционного процесса развивается патология эндокарда, перикарда и миокарда, возникает недостаточность по малому кругу кровообращения сердца и появляются такие признаки болезни:
- одышка в покое и при слабых нагрузках;
- кровохаркание;
- тяжелые аритмии;
- инфаркт миокарда;
- интенсивные сердечные боли;
- отеки;
- асцит (свободная жидкость в брюшной полости).
Поражение других органов
У больных с подострой формой патологии увеличиваются печень и селезенка, возникают боли справа или слева под ребрами. При поражении других органов появляются такие симптомы:
- воспаление суставов;
- кровь в моче, боли в почках;
- гипертензия;
- кишечные кровотечения;
- расстройства пищеварения;
- головные боли, бессонница (затронута нервная система).

Диагностика
Врач собирает данные анамнеза и проводит осмотр пациента такими способами:
- Аускультация – прослушивание сердечных шумов. Изменения будут слышны при диагностике болезни на 2-3 месяце.
- Перкуссия – простукивание грудной клетки для определения границ пораженного органа.
- Визуальный осмотр – выявляются пятна Лукина-Либмана, Рота, Джейнуэя, изменения цвета кожи, слизистых, ногтей, общее истощение.
Диагноз ставят после проведения комплекса обследований. Лабораторная диагностика включает в себя такие анализы:
- Биохимия крови – выявляются повышенный уровень лейкоцитов и увеличенная СОЭ (скорость оседания эритроцитов). Это основные маркеры воспаления.
- Анализ мочи – диагностика состояния почек: при их поражении видны частицы крови в материале.
- Кровь на бакпосев – определяется тип возбудителя инфекции для подбора схемы лечения. В 30% случаев он не выявляется. Забор материала для диагностики проводят 3 раза через каждые полчаса на пике лихорадки. У больных с подострым течением патологии интервал увеличивают, но анализ делают в течение суток.
- Исследование ревматоидного фактора – обнаруживается аутоиммунная реакция после инфицирования стрептококком.
Инструментальную диагностику проводят такими способами:
- ЭхоКГ (эхокардиограмма) – выявляет вегетации сердца диаметром более 5 мм, абсцессы.
- МРТ сердца (магнитно-резонансная томография) – проводится для детального изучения эндокарда и соседних тканей, изменений структуры, выявления осложнений на сосуды, суставы.
- Бронхоскопия – выполняется при подозрении на воспаление легких.
Обязательна дифференциальная диагностика для отделения бактериального эндокардита от ревматического. Для этого обращают внимание на такие признаки, свойственные инфекционной патологии:
- наличие вегетаций на снимке МРТ или ЭхоКГ;
- жалобы на обильное потоотделение;
- анемия (по результатам анализа крови);
- одинаковые микробы в повторных посевах.

Лечение инфекционного эндокардита
Больного кладут в стационар, терапию проводят с учетом таких правил:
- Воздействие на бактериальную флору осуществляется 4-8 недель бактерицидными препаратами.
- Антибиотики вводят через капельницу.
- При иммунных нарушениях используют кортикостероиды, антикоагулянты (запрещены при грибковом эндокардите).
- Симптоматическое лечение проводят препаратами для перорального приема.
- При отсутствии результата от лекарственных средств, в течение 4-х недель делают операцию.
- Для профилактики осложнений назначают диету, ограничивают нагрузки, стрессы.
Медикаментозная терапия

Лечение основано на инъекциях антибиотиков.
Если врач правильно подобрал препарат, на 2-3 день больной почувствует эффект.
В зависимости от типа бактериальной флоры в течение месяца применяют такие средства:
- Стрептококки – пенициллины (Бензилпенициллин) и аминогликозиды (Гентамицин).
- Стафилококки, энтерококки – пенициллины узкого спектра действия (Ампициллин, у детей – Амоксициллин), аминогликозиды (Гентамицин). Препаратом выбора является Ванкомицин (группа гликопептидов) одиночно. Детям с аллергией на пенициллины назначают макролиды (Азитромицин).
- Пневмококки – цефалоспорины (Цефотаксим, Цефтриаксон) и фторхинолоны (Левофлоксацин).
- Синегнойная палочка – цефалоспорины (Фортум, Цефтазидим).
- Грибковая флора – Амфотерицин В.

Для устранения осложнений и симптомов бакэндокардита назначают такие группы препаратов:
- Глюкокортикостероиды (Преднизолон) – снимают воспаление и иммунопатологические реакции, не рекомендованы детям.
- Антиагреганты (АСК-кардио) – препятствуют образованию сгустков крови.
- Нестероидные противовоспалительные средства (Диклофенак) – снимают боль при полиартрите, нефрите, миокардите.

Работу сердца поддерживают такими лекарствами:
- Адреноблокаторы (Конкор, Бипрол) – ослабляют влияние стресса, замедляют пульс, угнетают сердечную проводимость.
- Ингибиторы ангиотензинпревращающего фермента (Каптоприл, Ирумед) – снижают давление.
- Диуретики (Гипотиазид) – расслабляют стенки сосудов.
- Сердечные гликозиды (Коргликард) – усиливают работоспособность миокарда.
Хирургические методы
Операцию назначают при отсутствии эффекта от антибиотиков после 10 дней лечения или при таких состояниях:
- прогрессирующая сердечная недостаточность;
- сепсис;
- абсцесс (нагноение) сердца;
- массивные вегетации;
- бактериальный эндокардит у лиц с механическим клапанным аппаратом.
Хирургическое лечение инфекционного эндокардита проводят методом торакотомии (вскрывают грудную клетку), операция имеет 3 этапа:
- После искусственной стимуляции кровообращения в теле пациента при помощи аппарата врач проводит механическую санацию сердца – удаляет вегетации.
- Камеры обрабатывают антисептическими растворами. На недоступные участки воздействуют ультразвуком.
- Поврежденные клапаны заменяют протезами (в 10-50% случаев). Часто эту процедуру выполняют в ходе отдельной операции. После проходят курс лечения Амфотерицином В.

Прогноз и осложнения
При ранней диагностике и грамотно построенной схеме лечения больной живет 5 лет в 50-90% случаев.
Без терапии острая форма болезни приводит к смерти за 1-1,5 месяца, подострая – за полгода .
Прогноз для разных ситуаций такой:
- При грамотном лечении антибиотиками летальность снижается до 24-30%.
- У пожилых людей из-за поздней диагностики и вялого течения бактериального эндокардита вероятность смерти выше 40%.
- При инфекционном поражении протезированного клапана погибает 50% пациентов.
- Эндокардит становится хроническим у 10-15% больных и обостряется под влиянием внешних факторов.
- Тяжелое течение и высокий риск осложнений имеет инфекционное воспаление, которое вызывают бактерии и грибки. Вирусный эндокардит лучше поддается лечению, имеет более благоприятный прогноз.
- У детей в 85% случаев инфекционное воспаление эндокарда формирует пороки клапанов.
Смерть больного наступает из-за таких осложнений:
- септический шок;
- ишемия тканей (нарушение кровообращения);
- синдром полиорганной недостаточности;
- эмболия головного мозга;
- острая сердечная недостаточность.
Другие тяжелые последствия воспаления эндокарда:
- тромбоэмболия;
- тромбоз;
- аневризма аорты;
- миокардит, перикардит (воспаление сердечной мышцы и наружной оболочки);
- гепатит, цирроз;
- инфаркт легких, почек, селезенки, миокарда;
- пороки клапанов сердца;
- поражение селезенки – спленомегалия (увеличение), абсцесс, разрыв;
- инсульт;
- гемиплегия;
- менингоэнцефалит;
- нефротический синдром.
Профилактика эндокардита
Пациенты из группы риска должны находиться под контролем врача. Для защиты от инфицирования сердца соблюдайте такие рекомендации:
- после инструментальных обследований, хирургических вмешательств, принимайте назначенные врачом антибиотики;
- проводите санацию очагов хронической инфекции раз в квартал или полгода;
- избегайте переохлаждения;
- полностью проходите курс лечения вирусных и бактериальных инфекций;
- избегайте высоких физических нагрузок, стрессов;
- ограничивайте употребление соли (до 5 г на сутки), жирной пищи.

Видео
- Инфекционный эндокардит. Victor F. Huckell, MD, Clinical Professor of Medicine, University of British Columbia; Staff Cardiologist, Vancouver General Hospital