Содержание:
Способность крови свертываться с образованием сгустка в просвете кровеносных сосудов при их повреждении была известна с незапамятных времен. Создание первой научной теории свертывания крови в 1872 г. принадлежит А.А. Шмидту. Первоначально она сводилась к следующему: свертывание крови – ферментативный процесс; для свертывания крови необходимо присутствие трех веществ: фибриногена, фибринопластического вещества и тромбина.
В ходе реакции, катализируемой тромбином, первые два вещества, соединяясь между собой, образуют фибрин. Циркулирующая в сосудах кровь не свертывается по причине отсутствия в ней тромбина.
В результате дальнейших исследований А.А. Шмидта и его школы, а также Моравица, Гаммарстена, Спиро и др. было установлено, что образование фибрина происходит за счет одного предшественника – фибриногена.
Проферментом тромбина является протромбин, для процесса свертывания необходимы тромбокиназа тромбоцитов и ионы кальция.
Таким образом, через 20 лет после открытия тромбина была сформулирована классическая ферментативная теория свертывания крови, которая в литературе получила название теории Шмидта–Моравица.
Схематически теория Шмидта–Моравица может быть представлена в следующем виде:
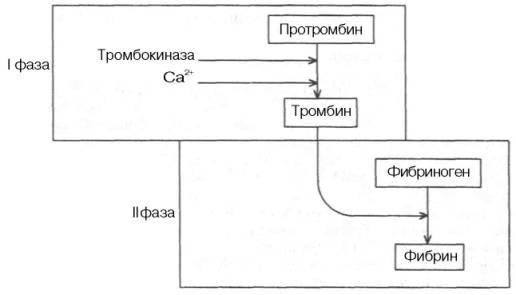
Протромбин переходит в активный фермент тромбин под влиянием тромбокиназы, содержащейся в тромбоцитах и освобождающейся из них при разрушении кровяных пластинок, и ионов кальция (I фаза). Затем под влиянием образовавшегося тромбина фибриноген превращается в фибрин (II фаза). Сравнительно простая по своей сути теория Шмидта–Моравица в дальнейшем необычайно усложнилась, обросла новыми сведениями, «превратив» свертывание крови в сложнейший ферментативный процесс.
282-283


Ткани и органы. Кровь
 При нарушении целостности кровеносной системы уменьшение кровопотери обеспечивает система гемостаза. Гемостаз поддерживается двумя путями: остановкой кровотечения с помощью тромбоцитов и свертыванием крови . В данном разделе основное внимание уделено ферментативным реакциям свертывания крови. Повторное растворение сгустков крови, фибринолиз , рассмотрен на с. 284.
При нарушении целостности кровеносной системы уменьшение кровопотери обеспечивает система гемостаза. Гемостаз поддерживается двумя путями: остановкой кровотечения с помощью тромбоцитов и свертыванием крови . В данном разделе основное внимание уделено ферментативным реакциям свертывания крови. Повторное растворение сгустков крови, фибринолиз , рассмотрен на с. 284.
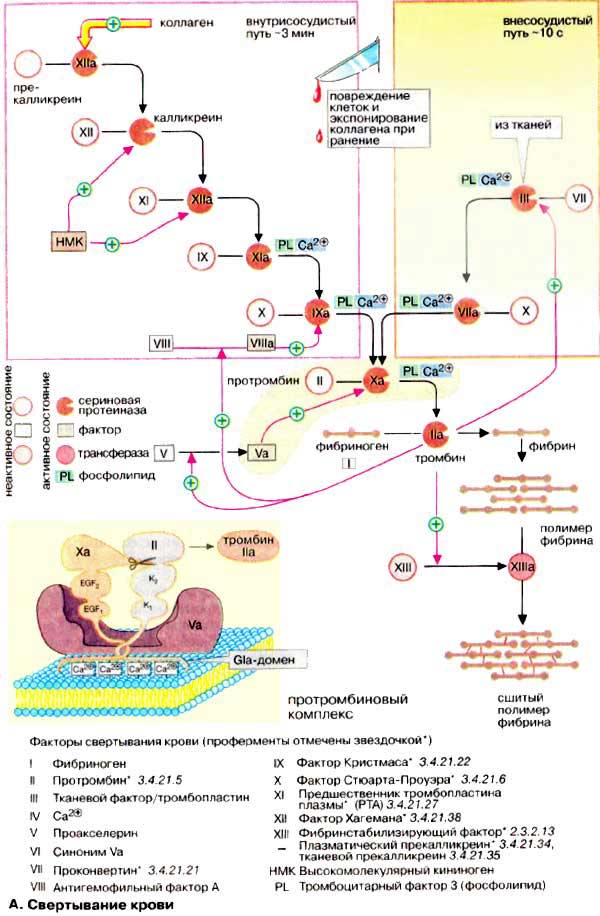
Номенклатура факторов свертывания крови несколько запутана. Факторы нумеруются римскими цифрами, при этом активированная форма фактора в наименовании содержит дополнительно букву «а» после римской цифры. Многие факторы являются протеиназами. На схеме неактивные предшественники протеиназ представлены в виде окружностей, а активные ферменты — окрашенными кружочками с вырезанным сектором. Вспомогательные факторы показаны в виде прямоугольников.
При свертывании крови происходит ферментативное превращение растворимого белка плазмы фибриногена (фактора I, см. рис. 71) в фибриновый полимер, сеть волокон нерастворимого белка. В этой реакции принимает участие фермент тромбин (фактор IIа), который протеолитически отщепляет от молекулы фибриногена небольшой пептидный фрагмент, в результате чего освобождаются участки связывания, что позволяет молекуле фибрина агрегировать в полимер . Затем с помощью глутамин-трансферазы (фактора XIII) образуются изопептидные связи боковых цепей аминокислот фибрина, что приводит к формированию нерастворимого фибринового сгустка (тромба).
Свертывание крови может запускаться двумя различными путями: вследствие нарушения целостности ткани ( внесосудистый путь, на схеме справа) или процессами, которые начинаются на внутренней поверхности сосуда ( внутрисосудистый путь , на схеме слева). В обоих случаях запускается каскад протеолитических реакций: из неактивных предшественников ферментов (зимогенов, условно обозначаемых на схеме окружностями) путем отщепления пептидов образуются активные сериновые протеиназы (обозначаемые на схеме окрашенными кружочками с вырезанным сектором), которые в свою очередь действуют на другие белки. Оба реакционных пути нуждаются в ионах Са 2+ и фосфолипидах [ФЛ (PL)] и оба завершаются активацией фактором Ха протромбина (фактора II) с образованием тромбина (IIа).
Внутрисосудистый путь инициируется коллагеном, который в норме не экспонирован на внутренней поверхности кровеносных сосудов; его контакт с кровью приводит к активации фактора XII. Внесосудистый путь активации начинается с освобождения фактора III (тканевого тромбопластина) из поврежденных клеток ткани. В течение нескольких секунд этот фактор приводит к свертыванию крови в области раны.
Факторы свертывания II, VII, IX и X содержат необычную аминокислоту, γ-карбоксиглутаминовую (Gla). Остатки Gla, которые образуются в результате посттрансляционного карбоксилирования остатков глутаминовой кислоты, группируются в особых белковых доменах. Они присоединяют ионы Са 2+ и вследствие этого связывают соответствующие регуляторные факторы с фосфолипидами на поверхности плазматической мембраны. На рисунке это схематически представлено на примере протромбинового комплекса (Va, Ха и II). Вещества, способные связывать свободные ионы Са 2+ в виде комплекса, например цитрат, предотвращают это взаимодействие с фосфолипидами и тормозят свертывание. Для синтеза остатков Gla необходим в качестве кофактора витамин К (см. с. 342). Антагонисты витамина К, такие, как дикумарин, подавляют синтез активных факторов коагуляции и действуют поэтому также как ингибиторы свертывания.
Генетически обусловленный дефицит отдельных факторов свертывания приводит к кровоточивости (гемофилия).
Контроль за свертыванием крови (не показан на схеме). Процесс свертывания крови находится в постоянном равновесии между активацией и торможением. Для торможения в плазме имеются очень эффективные ингибиторы протеиназ. Сериновые протеиназы системы свертывания инактивируются антитромбином. Его действие усиливается сульфатированным глюкозаминогликаном — гепарином (см. с. 336). Тромбомодулин, расположенный на внутренней стенке кровеносных сосудов, инактивирует тромбин, образуя с ним стехиометрический комплекс. За протеолитическое разрушение факторов V и VIII в плазме отвечает белок с. Этот белок в свою очередь активируется тромбином и, тем самым, реализуется самотормозящийся механизм свертывания крови.
Свёртывание крови — это важнейший этап работы системы гемостаза, отвечающий за остановку кровотечения при повреждении сосудистой системы организма. Совокупность взаимодействующих между собой весьма сложным образом различных факторов свёртывания крови образует систему свёртывания крови.
Свёртыванию крови предшествует стадия первичного сосудисто-тромбоцитарного гемостаза. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и механической закупоркой агрегатами тромбоцитов места повреждения сосудистой стенки. Характерное время для первичного гемостаза у здорового человека составляет 1—3 минуты. Собственно свёртыванием крови (гемокоагуляция, коагуляция, плазменный гемостаз, вторичный гемостаз) называют сложный биологический процесс образования в крови нитей белка фибрина, который полимеризуется и образует тромбы, в результате чего кровь теряет текучесть, приобретая творожистую консистенцию. Свёртывание крови у здорового человека происходит локально, в месте образования первичной тромбоцитарной пробки. Характерное время образования фибринового сгустка — около 10 минут . Свёртывание крови — ферментативный процесс.
Основоположником современной физиологической теории свёртывания крови является Александр Шмидт. В научных исследованиях XXI века , проведённых на базе Гематологического научного центра под руководством Атауллаханова Ф. И. , было убедительно показано [1] [2] , что свёртывание крови представляет собой типичный автоволновой процесс, в котором существенная роль принадлежит эффектам бифуркационной памяти.
Содержание
Физиология [ править | править код ]

Процесс гемостаза сводится к образованию тромбоцитарно-фибринового сгустка. Условно его разделяют на три стадии [3] :
- временный (первичный) спазм сосудов;
- образование тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов;
- ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена гликопротеином фактором Виллебранда [4] . Одновременно с адгезией наступает агрегация тромбоцитов: активированные тромбоциты присоединяются к повреждённым тканям и друг к другу, формируя агрегаты, преграждающие путь потере крови. Появляется тромбоцитарная пробка [3] .
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются различные биологически активные вещества (АДФ, адреналин, норадреналин и другие), которые приводят к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина [3] , который воздействует на фибриноген с образованием сети фибрина, в которой застревают отдельные эритроциты и лейкоциты – образуется так называемый тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка). Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, наступает её ретракция [3] .
Процесс свёртывания крови [ править | править код ]


Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови [3] . В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активации включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции — образование фибрина из фибриногена;
- фаза ретракции — образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году [5] Моравицем и до сих пор не утратила своей актуальности [6] .
В области детального понимания процесса свёртывания крови с 1905 года произошёл значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свёртывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса.
Современное представление с позиций физиологии каскада реакций, сопровождающих свёртывание крови, представлено на рис. 2 и 3. Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca 2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, речь идёт о внешней системе свёртывания крови (внешний путь активации свёртывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания. Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа). Внешняя и внутренняя системы свёртывания крови дополняют друг друга [5] .
В процессе адгезии форма тромбоцитов меняется — они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны [5] .
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca 2+ .
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой — блокируя поступление в кровь внешних веществ и микроорганизмов. На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы — замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин, гирудин и другие), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией.
Методы диагностики свёртывания крови [ править | править код ]
Все многообразие клинических тестов свёртывающей системы крови можно разделить на две группы [7] :
- глобальные (интегральные, общие) тесты;
- «локальные» (специфические) тесты.
Глобальные тесты характеризуют результат работы всего каскада свёртывания. Они подходят для диагностики общего состояния свёртывающей системы крови и выраженности патологий, с одновременным учётом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свёртывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. «Локальные» тесты характеризуют результат работы отдельных звеньев каскада свёртывающей системы крови, а также отдельных факторов свёртывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свёртывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
- определение времени свёртывания цельной крови (методы Сухарева, Мас-Магро, Моравица);
- тромбоэластография;
- тест генерации тромбина (тромбиновый потенциал, эндогенный тромбиновый потенциал);
- тромбодинамика.
- активированное частичное тромбопластиновое время (АЧТВ);
- тест протромбинового времени (или протромбиновый тест, МНО, ПВ);
- узкоспециализированные методы для выявления изменений в концентрации отдельных факторов.
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свёртывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. сlot — сгусток).
Нарушения свёртывания крови [ править | править код ]
Нарушения свёртываемости крови могут быть обусловлены дефицитом одного или нескольких факторов свёртывания крови, появлением в циркулирующей крови их иммунных ингибиторов