Содержание:
Свёртывание крови — это важнейший этап работы системы гемостаза, отвечающий за остановку кровотечения при повреждении сосудистой системы организма. Совокупность взаимодействующих между собой весьма сложным образом различных факторов свёртывания крови образует систему свёртывания крови.
Свёртыванию крови предшествует стадия первичного сосудисто-тромбоцитарного гемостаза. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и механической закупоркой агрегатами тромбоцитов места повреждения сосудистой стенки. Характерное время для первичного гемостаза у здорового человека составляет 1—3 минуты. Собственно свёртыванием крови (гемокоагуляция, коагуляция, плазменный гемостаз, вторичный гемостаз) называют сложный биологический процесс образования в крови нитей белка фибрина, который полимеризуется и образует тромбы, в результате чего кровь теряет текучесть, приобретая творожистую консистенцию. Свёртывание крови у здорового человека происходит локально, в месте образования первичной тромбоцитарной пробки. Характерное время образования фибринового сгустка — около 10 минут . Свёртывание крови — ферментативный процесс.
Основоположником современной физиологической теории свёртывания крови является Александр Шмидт. В научных исследованиях XXI века , проведённых на базе Гематологического научного центра под руководством Атауллаханова Ф. И. , было убедительно показано [1] [2] , что свёртывание крови представляет собой типичный автоволновой процесс, в котором существенная роль принадлежит эффектам бифуркационной памяти.
Содержание
Физиология [ править | править код ]

Процесс гемостаза сводится к образованию тромбоцитарно-фибринового сгустка. Условно его разделяют на три стадии [3] :
- временный (первичный) спазм сосудов;
- образование тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов;
- ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена гликопротеином фактором Виллебранда [4] . Одновременно с адгезией наступает агрегация тромбоцитов: активированные тромбоциты присоединяются к повреждённым тканям и друг к другу, формируя агрегаты, преграждающие путь потере крови. Появляется тромбоцитарная пробка [3] .
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются различные биологически активные вещества (АДФ, адреналин, норадреналин и другие), которые приводят к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина [3] , который воздействует на фибриноген с образованием сети фибрина, в которой застревают отдельные эритроциты и лейкоциты – образуется так называемый тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка). Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, наступает её ретракция [3] .
Процесс свёртывания крови [ править | править код ]


Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови [3] . В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активации включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции — образование фибрина из фибриногена;
- фаза ретракции — образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году [5] Моравицем и до сих пор не утратила своей актуальности [6] .
В области детального понимания процесса свёртывания крови с 1905 года произошёл значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свёртывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса.
Современное представление с позиций физиологии каскада реакций, сопровождающих свёртывание крови, представлено на рис. 2 и 3. Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca 2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани, речь идёт о внешней системе свёртывания крови (внешний путь активации свёртывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания. Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа). Внешняя и внутренняя системы свёртывания крови дополняют друг друга [5] .
В процессе адгезии форма тромбоцитов меняется — они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны [5] .
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca 2+ .
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой — блокируя поступление в кровь внешних веществ и микроорганизмов. На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы — замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин, гирудин и другие), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией.
Методы диагностики свёртывания крови [ править | править код ]
Все многообразие клинических тестов свёртывающей системы крови можно разделить на две группы [7] :
- глобальные (интегральные, общие) тесты;
- «локальные» (специфические) тесты.
Глобальные тесты характеризуют результат работы всего каскада свёртывания. Они подходят для диагностики общего состояния свёртывающей системы крови и выраженности патологий, с одновременным учётом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свёртывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. «Локальные» тесты характеризуют результат работы отдельных звеньев каскада свёртывающей системы крови, а также отдельных факторов свёртывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свёртывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
- определение времени свёртывания цельной крови (методы Сухарева, Мас-Магро, Моравица);
- тромбоэластография;
- тест генерации тромбина (тромбиновый потенциал, эндогенный тромбиновый потенциал);
- тромбодинамика.
- активированное частичное тромбопластиновое время (АЧТВ);
- тест протромбинового времени (или протромбиновый тест, МНО, ПВ);
- узкоспециализированные методы для выявления изменений в концентрации отдельных факторов.
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свёртывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. сlot — сгусток).
Нарушения свёртывания крови [ править | править код ]
Нарушения свёртываемости крови могут быть обусловлены дефицитом одного или нескольких факторов свёртывания крови, появлением в циркулирующей крови их иммунных ингибиторов
Процесс свертывания крови
 Процесс свёртывания крови имеет очень большое значение при необходимости заживления ран и мелких порезов. Свёртывание крови индивидуально у каждого человека и определяется его физиологическими особенностями. Во время течения крови по сосудам человека её субстанция жидкая, но при получении человеком ранения происходят изменения в консистенции крови. Это проявляется в возникновении тромба или сгустка крови. Он играет роль своеобразной пробки, необходимой для закупоривания ранки. Именно этот тромб и служит для остановки крови и её сворачивания. Ранее полученное повреждение постепенно устраняется и ранка заживает. Именно это и объясняется течением процесса сворачиваемости крови. Здоровому организму требуется не больше пяти минут для полной остановки крови и её последующего сворачивания.
Процесс свёртывания крови имеет очень большое значение при необходимости заживления ран и мелких порезов. Свёртывание крови индивидуально у каждого человека и определяется его физиологическими особенностями. Во время течения крови по сосудам человека её субстанция жидкая, но при получении человеком ранения происходят изменения в консистенции крови. Это проявляется в возникновении тромба или сгустка крови. Он играет роль своеобразной пробки, необходимой для закупоривания ранки. Именно этот тромб и служит для остановки крови и её сворачивания. Ранее полученное повреждение постепенно устраняется и ранка заживает. Именно это и объясняется течением процесса сворачиваемости крови. Здоровому организму требуется не больше пяти минут для полной остановки крови и её последующего сворачивания.
Однако, бывают случаи, при которых имеют место нарушения течения процесса сворачиваемости крови. В частности это относится к заболеванию гемофилией. Таким больным следует соблюдать осторожность на протяжение всей своей жизни, поскольку в их случае летальный исход может быть вызван даже небольшим порезом. Имелись случаи, когда сильное кровотечение имело место даже без видимых внешних механических повреждений и связано оно было именно с нарушением процесса сворачиваемости крови. Известна эта, достаточно редкая болезнь, была ещё в древние времена. В частности, нарушениями процесса сворачиваемости крови страдали представители правящих династий.
Кроме того, имеют место и иные нарушения процесса сворачиваемости крови. Изменения состава крови могут иметь патологический характер и именно это и становится нарушением течения процесса её сворачиваемости. В подобных случаях чаще всего имеет место так называемое внутрисосудистое свёртывание крови. В результате этого появляются заболевания, более тяжёлые по сравнению с гемофилией. Это можно сказать об инфаркте миокарда или тромбозе сосудов головного мозга. Прогноз течения таких заболеваний может быть крайне неприятным.
Система свертывания крови
Система свёртывания крови имеет определённые функции, среди которых можно выделить следующие:
- Кровь в сосудах поддерживается в жидком состоянии.
- Осуществляется гомеостаз, следствием которого является отсутствие больших потерь крови.
Гомеостазом называется сложный процесс, ферментативного типа, конечным результатом которого становится образование сгустка крови.
Система свёртывания крови включает в себя множество компонентов, она включает в свой состав белки, кальциевые ионы, обломки мембран клеток, фосфолипиды. Компоненты системы свёртывания крови принято именовать факторами, которые могут быть плазменными, тромбоцитарными и тканевыми. Первый и последний из приведенных факторов чаще всего обозначаются римскими цифрами, в то время, как тромбоцитарные факторы обозначаются цифрами арабскими. Активный фактор также принято обозначать литерой «а».
Основная масса белков системы сворачиваемости крови характеризуется ферментативной активностью. Факторы, отвечающие за течение процесса сворачиваемости крови, характеризуются способностью становиться катализаторами реакций ограниченного протеолиза. Они имеют название сериновых протеиназов.
При течении реакций сворачивания крови белки выполняют функцию субстрата, после чего становятся ферментом. В числе белков, которые принимают участие в течение процесса сворачиваемости крови, имеются такие, которые ферментной активностью не характеризуются, однако ускоряют течение ферментативной реакции. Их называют параферментами.
Основная масса факторов сворачиваемости крови проходит синтез в неактивной форме и имеет вид параферментов. Они активизируются и их действие бывает направлено на течение прямой реакции сворачиваемости крови. В результате ферминоген превращается в фибрин и именно он составляет основу образовавшегося сгустка крови.
Время свертывания крови
Методов определения времени сворачиваемости крови существует несколько, можно отметить некоторые из них.
- Метод Моравица предполагает помещение на предметное стекло капли крови, после чего по ней проводят в различных направлениях палочкой из стекла. Периодом сворачивания крови в данном случае можно называть период времени, прошедшего с того момента, как кровь была нанесена, до момента возникновения нитей фибрина. Чаще всего для этого требуется пять минут.
- Не представляет никакой сложности проведение метода Мас-Магро. Он предполагает нанесение вазелина на покрытое парафином стекло, после чего из пипетки на это стекло капают кровью. Из капли вазелина кровь отбирается также при помощи пипетки, после чего она выпускается обратно до возникновения кровяного сгустка. Время сворачивания крови при этом тщательно фиксируется.
- Способ Уайт-Литла предполагает помещение крови в три пробирки из силикона. В каждой из пробирок находится по одному миллилитру крови. После этого кровь в пробирках нагревается до 37°С и пробирки помещаются под наклоном. Принято судить об окончании процесса после того, как кровь в пробирках перестаёт двигаться. По этому методу время сворачивания крови определяется в шесть минут.
- При методе Сухарева следует поместить в трубку капилляра 30 миллилитров крови. Она перегоняется в среднюю часть капилляра, при этом из него устраняется первая капля. По истечении каждых 30 секунд следует наклонять капилляр. Отсчёт прекращается сразу же после того, как кровь прекращает поступать. По данному методу время сворачивания крови определяется от двух до пяти минут.
Полное количество подобных методов около тридцати. Время сворачивания крови, установленное ими, варьируется до двух до пяти минут. Три первых метода из описанных выше принято считать самыми простыми. Метод Сухарева относят к унифицированным, однако и он не даёт стабильных результатов. При проведении анализа на время свёртывания крови обязательно следует указывать, по какому из методов он был проведен.

Факторы свертывания крови
Приныто условное обозначение рассматриваемых показателей римскими цифрами, они представляют собой особые белки плазмы крови, которые участвуют в процессе её сворачивания. Они производят циркуляцию в потоке крови, проявленные в ней в пассивной форме. При механическом травмировании стенок сосудов происходит запуск каскадной цепи реакций, при этом факторы свертывания крови принимают активную форму. Активатор протромбина высвобождается в самую первую очередь, при этом он обуславливает превращение протромбина в тромбин. При помощи тромбина происходит расщепление крупной молекулы глобулярного белка на более мелкие составляющие, впоследствии они снова соединяются в продолговатые нити фибрина, фибриллярного белка, который не подлежит расщеплению. Свёртывание одного миллилитра крови предполагает образование тромбина, которого оказывается вполне достаточно для коагуляции содержащегося в трёх литрах крови фибриногена. Тем не менее, при полноценных физиологических условиях происходит генерация тромбина лишь там, где повреждена сосудистая стенка.
Пути сворачивания крови можно разделить на внутренний и наружный, в зависимости от имеющихся сценариев пуска. В обоих путях сворачивания крови имеет место активизация факторов сворачивания крови на мембранах повреждённых клеток. При наружном пути сворачивания крови тканевой фактор активации тромбопластин направляется в кровь из тканей сосудов, которые ранее получили повреждение. Внешним этот путь именуется, поскольку он направляется из наружного пространства. При внутреннем свёртывании крови имеет место поступление сигнала от тромбоцитов ранее активированных, внутренним этот путь назван, поскольку они считаются основными факторами крови. Принимая во внимание факт тесной взаимосвязи в организме человека этих двух процессов сворачиваемости крови разделение можно считать достаточно условным. Однако оно существенно упрощает интерпретацию проводимых для оценки сворачиваемости крови тестов.
Определение свертывания крови
Методы проведения анализа крови на сворачиваемость разделяются на четыре основные группы:
- Общие методы, которые способны дать только ориентировочное представление о том, в каком состоянии пребывает коагуляционный каскад. Также даётся общая оценка состояния отдельных его этапов. При проведении возможно применение специальных приборов, а также выдача визуальной оценки.
- Позволяющие конкретно оценить нехватку определённых факторов сворачиваемости крови. Подразумевает применение коррекционных коагуляционных тестов, при которых производится смешивание плазмы крови с аналогичным веществом больных, у которых уже обнаружен дефицит тех или иных факторов сворачиваемости крови.
- Метод проведения количественной оценки частных составляющих системы по их отдельной активности, а также по иммунологическим маркерам.
- Определение протекающего в глубине сосудов процесса сворачиваемости крови и фибринолоза по функциональному определению. Также принимаются во внимание молекулярные маркеры подобной активации. В процессе циркуляции определяются факторы сворачивания крови, продукты дегрануляции, тромбоциты. Кроме того выявляются новые антигенные маркеры факторов активации и их комплексы, ускоряется метаболизация помеченных компонентов сворачивающейся кровяной системы.
Таким образом, в целях определения свёртывания крови применяются не только прводимые в лабораториях методики. Кроме них проводятся иные виды исследования, такие, как радионуклидные и иммунологические. Во большом числе случаев составляющие систему компоненты могут быть определены как иммунологически, так и по принципам активности функциональной.
Анализ на свертывание крови
Анализ крови на свёртываемость носит название коагулограммы. Для сдачи подобного анализа следует предварительно определиться с показаниями. Некоторые заболевания предполагают нарушения процессов сворачиваемости крови, именно эти болезни и представляют собой основание для проведения анализа на сворачиваемость крови.
Среди подобных болезней можно выделить:
- заболевания аутоиммунного характера;
- сбои полноценного функционирования печени;
- патологии развития сердца и сосудов;
- варикозные расширения вен;
- заболевания сахарным диабетом;
- острая форма гемохроматоза.
Кроме того, проведение анализа на свёртываемость крови оказывается необходимым при определённых состояниях:
- при беременности;
- в периоды после проведения операции или непосредственно перед ней;
- при проведении контроля во время лечения антикоагулянтами;
- если имеется подозрение на продолжительную остановку сердца.
Нормы анализа на сворачиваемость крови могут существенно отличаться друг от друга в различных лабораториях. Решающее слово в подобной ситуации всегда принадлежит лечащему врачу. Кроме того, следует понимать, что нормы проведения анализа могут существенно отличаться в различных триместрах беременности.
Существует восемь норм проведения анализа на сворачиваемость крови:
- Анализ непосредственно самой крови на период сворачиваемости. Норма сворачиваемости венозной крови составляет десять минут, для капиллярной установлена норма в две минуты. Низкая сворачиваемость крови характеризуется увеличением этого параметра, его уменьшение свидетельствует о сверхвысокой сворачиваемости.
- Так называемое активированное частичное тромбопластированное время. нормальное его значение составляет от 25 до 35 секунд. Увеличение указанного временного интервала свидетельствует о плохой сворачиваемости крови, его уменьшение говорит о гиперкоагуляции.
- Протромбиновый индекс, является периодом времени, которое считывается для определения внешнего пути сворачивания крови. В норме он составляет от 80 % до 120%. Меньшее значение является признаком гиперкоагуляции, в то время, как высокое свидетельствует о нарушении способности крови к сворачиванию.
- Плазменный белок — фибриноген. Нормальное значение показателя составляет от 5,9 до 11,7 мкмоль/л. Возможно его повышение в случае беременности, при инфарктах и ожогах. Если значение показателя понижается это свидетельствует от ДВС-синдроме или болезнях печени.
- Тромбиновый период времени. Оценивает завершающую стадию процесса сворачивания. Нормальное значение показателя от 11 до 18 секунд. Дефицит фибриногена сопровождается увеличением этого показателя, в то время как его уменьшение свидетельствует о повышенной концентрации фибриногена в крови.
- Нормальное значение времени рекальцификации плазмы в крови составляет от одной до двух минут.
- Тест на определение толерантности кровяной плазмы к гепарину применяется далеко не во всех случаях. Нормальным значением является время от трёх до одиннадцати минут.
- Нормальное значение параметра ретракции сгустка крови составляет от 44 до 65%
При проведении анализа крови на сворачиваемость в течении восьми часов до него не следует принимать пищу. Кровь на анализ берут из вены, это требуется для проведения оценки состояния венозной крови. Если требуется оценить сворачиваемость капиллярной крови следует взять кровь из пальца.

Нарушения свертывания крови
Чаще всего нарушения свёртывания крови проявляются в возникновении на коже синяков. Они могут возникнуть неожиданно или быть результатом повреждения кожи при играх или работе. Возможно их появление при несущественных механических повреждениях. Тем более, если они наблюдаются при повторных кровотечениях из носа или в результате травмирования других частей тела. Кроме того существенно усиливается кровоточивость из дёсен, возникают раны и порезы.
Причины нарушения свертывания крови
Прежде чем дать определение основным причинам нарушения сворачиваемости крови следует определиться с понятием коагуляции крови. Принято считать, что коагуляция крови при остановке кровотечения представляет собой комплексное сочетание течение очень сложных процессов биохимического свойства, которые обуславливаются воздействием и совместным действием сорока физиологически активных веществ, представляющих собой плазменные и тромбоцитарные факторы свёртывания крови.
Нарушения процесса сворачиваемости крови напрямую связаны с разбалансировкой совместного действия факторов её свёртываемости, поскольку только в случае их совместного действия активизируется механизм естественного образования сгустка крови, после чего кровотечение останавливается. Не менее важным фактором, влияющим на нарушение процессов свёртывания крови, является объём в крови тромбоцитов, которые синтезируются клетками костного мозга.
Плохая свёртываемость крови может быть связана с нарушениями наследственного характера. Прежде всего это можно сказать о гемофилии и заболевании Виллебранда. Последнее заболевание характеризуется отсутствием в составе крови соответствующего фактора, которые и обуславливает нарушение сворачиваемости крови.
Очень часто причиной нарушения свёртывания крови является повреждение печение или нарушения её функционирования. Это в равной мере можно отнести как к инфекционным заболеваниям, в частности гепатит, так и к болезням, сопровождающимся появлением рубцов, таким, как цирроз печени.
Нарушение свертывания крови при заболеваниях
Помимо гемофилии, болезни Виллебрандта, а также заболеваний, связанных с повреждением печени, нарушение свёртываемости крови может быть связано с иными болезнями. Причина может быть в наследственных заболеваниях, при которых в организме человека, в частности в его крови, отсутствует фибриноген. Это само по себе способно стать причиной нарушения нормального течения процесса свёртывания крови.
Определённые заболевания могут стать причиной пониженного содержания в крови человека тромбоцитов и их разрушения в селезёнке. Результатом станет острая форма патогенеза идиопатической тромбоцитопении, при которой происходят нарушения нормального свёртывания крови.
При случайных повреждениях мелких кровеносных сосудов возникающее кровотечение через некоторое время прекращается. Это связано с образованием в месте повреждения сосуда тромба или сгустка. Данный процесс называется свёртыванием крови.
В настоящее время существует классическая ферментативная теория свертывания крови – теория Шмидта – Моравица. Положения этой теории представлены на схеме (рис. 11):
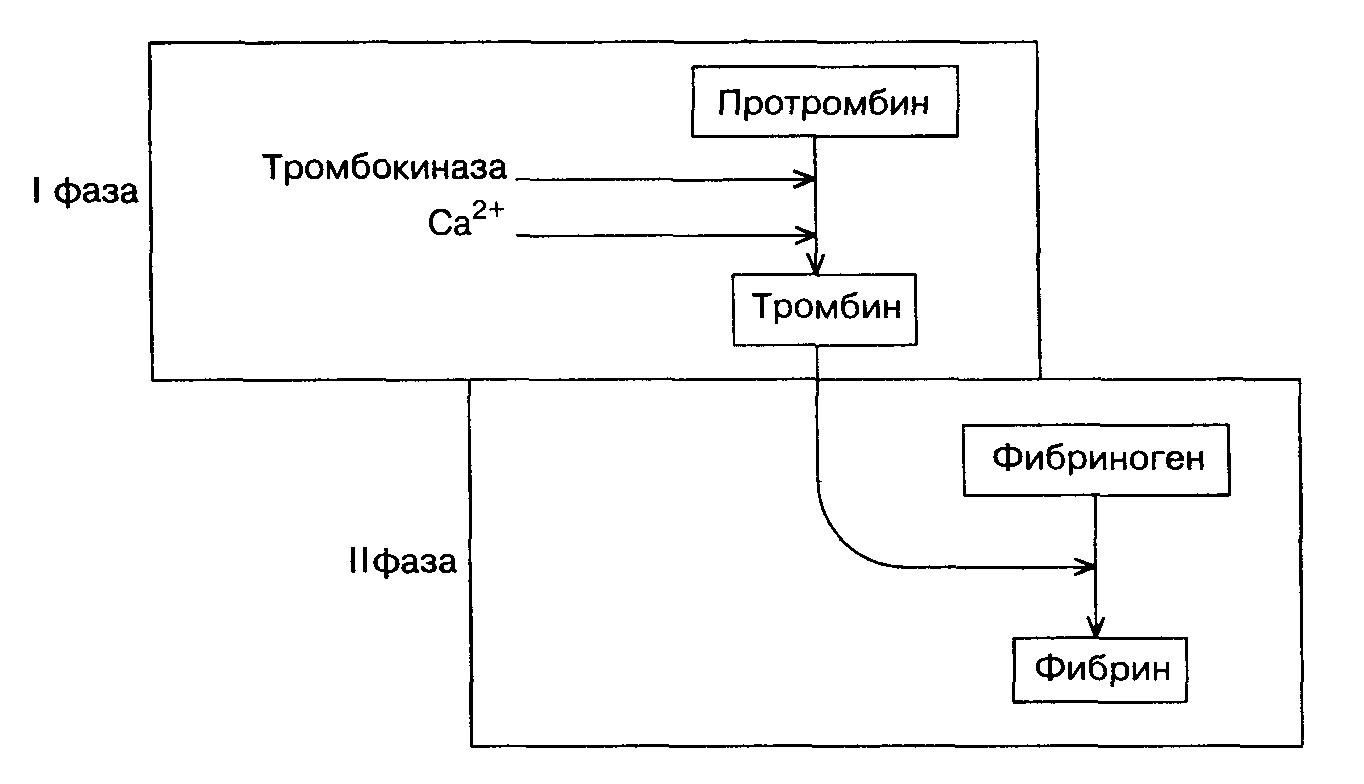
Рис. 11. Схема свертывания крови
Повреждение кровеносного сосуда вызывает каскад молекулярных процессов, в результате образуется сгусток крови — тромб, прекращающий вытекание крови. В месте повреждения к открывшемуся межклеточному матриксу прикрепляются тромбоциты; возникает тромбоцитарная пробка. Одновременно включается система реакций, ведущих к превращению растворимого белка плазмы фибриногена в нерастворимый фибрин, который откладывается в тромбоцитарной пробке и на её поверхности, образуется тромб.
Процесс свёртывания крови протекает в две фазы.
В первой фазепротромбин переходит в активный фермент тромбин под влиянием тромбокиназы, содержащейся в тромбоцитах и освобождающейся из них при разрушении кровяных пластинок, и ионов кальция.
Во второй фазепод влиянием образовавшегося тромбина фибриноген превращается в фибрин.
Весь процесс свёртывания крови представлен следующими фазами гемостаза:
а) сокращение поврежденного сосуда;
б) образование в месте повреждения рыхлой тромбоцитарной пробки, или белого тромба. Коллаген сосуда служит связующим центром для тромбоцитов. При агрегации тромбоцитов освобождаются вазоактивные амины, которые стимулируют сужение сосудов;
в) формирование красного тромба (кровяной сгусток);
г) частичное или полное растворение сгустка.
Белый тромб образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов (в условиях высокой скорости кровотока). Красный тромб состоит из эритроцитов и фибрина (в областях замедленного кровотока).
В процессе свертывания крови участвуют факторы свертывания крови. Факторы свертывания, связанные с тромбоцитами, принято обозначать арабскими цифрами (1, 2, 3 и т.д.), а факторы свертывания, находящиеся в плазме крови, обозначают римскими цифрами.
Фактор I (фибриноген) — гликопротеин. Синтезируется в печени.
Фактор II (протромбин) — гликопротеин. Синтезируется в печени при участии витамин К. Способен связывать ионы кальция. При гидролитическом расщеплении протромбина образуется активный фермент свертывания крови.
Фактор III (тканевый фактор, или тканевый тромбопластин) образуется при повреждении тканей. Липопротеин.
Фактор IV (ионы Са 2+ ). Необходимы для образования активного фактораXи активного тромбопластина тканей, активации проконвертина, образования тромбина, лабилизации мембран тромбоцитов.
Фактор V (проакцелерин) — глобулин. Предшественник акцелерина, синтезируется в печени.
Фактор VII (антифибринолизин, проконвертин)- предшественник конвертина. Синтезируется в печени при участии витамина К.
Фактор VIII (антигемофильный глобулин А) необходим для формирования активного фактораX. Врожденный недостаток фактораVIII- причина гемофилии А.
Фактор IX (антигемофильный глобулин В, Кристмас-фактор) принимает участие в образовании активного фактораX. При недостаточностьи фактораIXразвивается гемофилия В.
Фактор X (фактор Стюарта-Прауэра) — глобулин. ФакторXучаствует в образовании тромбина из протромбина. Синтезируется клетками печени при участии витамина К.
Фактор XI (фактор Розенталя) — антигемофильный фактор белковой природы. Недостаточность наблюдается при гемофилии С.
Фактор XII (фактор Хагемана) участвует в пусковом механизме свертывания крови, стимулирует фибринолитическую активность, другие защитные реакции организма.
Фактор XIII (фибринстабилизирующий фактор) — участвует в образовании межмолекулярных связей в фибрин-полимере.
Факторы тромбоцитов. В настоящее время известно около 10 отдельных факторов тромбоцитов. Например: Фактор 1 — адсорбированный на поверхности тромбоцитов проакцелерин. Фактор 4 — антигепариновый фактор.
В нормальных условиях тромбина в крови нет, он образуется из белка плазмы протромбина под действием протеолитического фермента фактора Ха (индекс а — активная форма), который образуется при кровопотере из фактора X. Фактор Ха превращает протромбин в тромбин только в присутствии ионов Са 2 + и других факторов свертывания.
Фактор III, переходящий в плазму крови при повреждении тканей, и фактор 3 тромбоцитов создают предпосылки для образования затравочного количества тромбина из протромбина. Он катализирует превращение проакцелерина и проконвертина в акцелерин (факторVa) и в конвертин (факторVIIa).
При взаимодействии перечисленных факторов, а также ионов Са 2+ происходит образование фактора Ха. Затем происходит образование тромбина из протромбина. Под влиянием тромбина от фибриногена отщепляются 2 пептида А и 2 пептида В. Фибриноген превращается в хорошо растворимый фибрин-мономер, который быстро полимеризуется в нерастворимый фибрин-полимер при участии фибринстабилизирующего фактора- фактораXIII(фермент трансглутаминаза) в присутствии ионов Са 2+ (рис. 12).
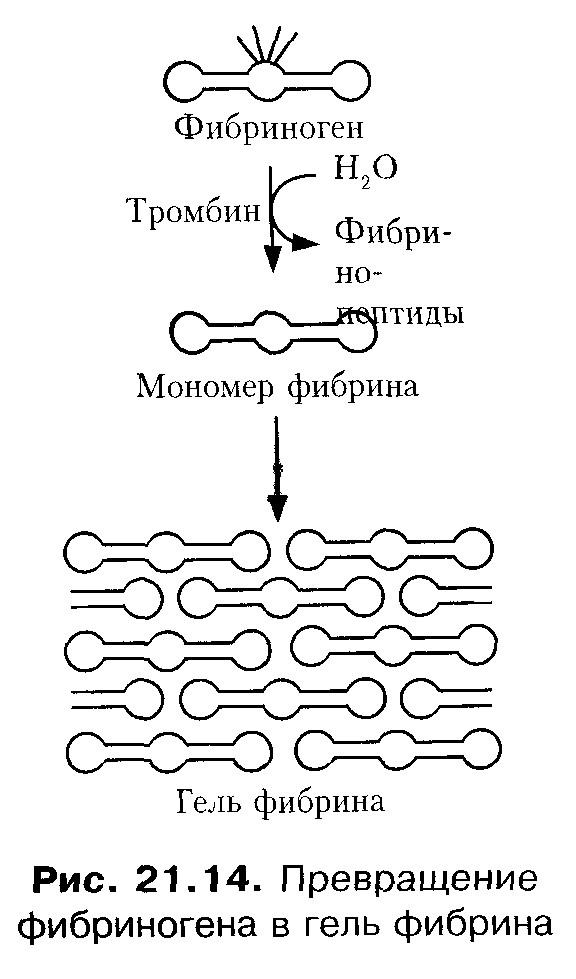
Рис. 12. Образование геля фибрина.
Фибриновый тромб прикрепляется к матриксу в области повреждения сосуда при участии белка фибронектина. Вслед за образованием нитей фибрина происходит их сокращение, для чего необходима энергия АТФ и фактор 8 тромбоцитов (тромбостенин).
У людей с наследственными дефектами трансглутаминазы кровь свертывается так же, как у здоровых, однако тромб получается хрупкий, поэтому легко возникают вторичные кровотечения.
Кровотечение из капилляров и мелких сосудов останавливается уже при образовании тромбоцитной пробки. Для остановки кровотечения из более крупных сосудов необходимо быстрое образование прочного тромба, чтобы свести к минимуму потерю крови. Это достигается каскадом ферментных реакций с механизмами усиления на многих ступенях.
Различают три механизма активации ферментов каскада:
1. Частичный протеолиз.
2. Взаимодействие с белками-активаторами.
3. Взаимодействие с клеточными мембранами.
Ферменты прокоагулянтного пути содержат γ-карбоксиглутаминовую кислоту. Радикалы карбоксиглутаминовой кислоты образуют центры связывания ионов Са 2+ . В отсутствие ионов Са 2+ кровь не свертывается.
Внешний и внутренний пути свёртывания крови.
Во внешнем пути свертывания кровиучаствуют тромбопластин (тканевой фактор, факторIII), проконвертин (факторVII), фактор Стюарта (факторX), проакцелерин (факторV), а также Са 2+ и фосфолипиды мембранных поверхностей, на которых образуется тромб. Гомогенаты многих тканей ускоряют свёртывание крови: это действие называют тромбопластиновой активностью. Вероятно, она связана с наличием в тканях какого-то специального белка. ФакторыVIIиX- проферменты. Они активируются путём частичного протеолиза, превращаясь в протеолитические ферменты — факторыVIIа иXа соответственно. ФакторV– это белок, который при действии тромбина превращается в факторV’, который не является ферментом, но активирует ферментXа по аллостерическому механизму; активация усиливается в присутствии фосфолипидов и Са 2+ .
В плазме крови постоянно содержатся следовые количества фактора VIIа. При повреждении тканей и стенок сосуда освобождается факторIII– мощный активатор фактораVIIа; активность последнего увеличивается более чем в 15000 раз. ФакторVIIа отщепляет часть пептидной цепи фактораX, превращая его в фермент — факторXа. Сходным образомXа активирует протромбин; образовавшийся тромбин катализирует превращение фибриногена в фибрин, а также превращение предшественника трансглутаминазы в активный фермент (факторXIIIа). Этот каскад реакций имеет положительные обратные связи, усиливающие конечный результат. ФакторXа и тромбин катализируют превращение неактивного фактораVIIв ферментVIIа; тромбин превращает факторVв факторV’, который вместе с фосфолипидами и Са 2+ в 10 4 –10 5 раз повышает активность фактораXа. Благодаря положительным обратным связям скорость образования самого тромбина и, следовательно, превращения фибриногена в фибрин нарастают лавинообразно, и в течение 10-12 с кровь свёртывается.
Свёртывание крови по внутреннему механизмупроисходит значительно медленнее и требует 10-15 мин. Этот механизм называют внутренним, потому что для него не требуется тромбопластин (тканевой фактор) и все необходимые факторы содержатся в крови. Внутренний механизм свёртывания также представляет собой каскад последовательных активаций проферментов. Начиная со стадии превращения фактораXвXа, внешний и внутренний пути одинаковы. Как и внешний путь, внутренний путь свёртывания имеет положительные обратные связи: тромбин катализирует превращение предшественниковVиVIIIв активаторыV’ иVIII’, которые в конечном итоге увеличивают скорость образования самого тромбина.
Внешний и внутренний механизмы свёртывания крови взаимодействуют между собой. Фактор VII, специфичный для внешнего пути свёртывания, может быть активирован факторомXIIа, который участвует во внутреннем пути свёртывания. Это превращает оба пути в единую систему свёртывания крови.
Гемофилии. Наследственные дефекты белков, участвующих в свёртывании крови, проявляются повышением кровоточивости. Наиболее часто встречается болезнь, вызванная отсутствием фактораVIII– гемофилия А. Ген фактораVIIIлокализован вX- хромосоме; повреждение этого гена проявляется как рецессивный признак, поэтому у женщин гемофилии А не бывает. У мужчин, имеющих однуX-хромосому, наследование дефектного гена приводит к гемофилии. Признаки болезни обычно обнаруживаются в раннем детстве: при малейшем порезе, а то и спонтанно возникают кровотечения; характерны внутрисуставные кровоизлияния. Частая потеря крови приводит к развитию железодефицитной анемии. Для остановки кровотечения при гемофилии вводят свежую донорскую кровь, содержащую факторVIII, или препараты фактораVIII.
Гемофилия В. Гемофилия В обусловлена мутациями гена фактора IX, который, как и ген фактораVIII, локализован в половой хромосоме; мутации рецессивны, следовательно, гемофилия В бывает только у мужчин. Гемофилия В встречается примерно в 5 раз реже, чем гемофилия А. Лечат гемофилию В введением препаратов фактораIX.
При повышенной свертываемости кровимогут образоваться внутрисосудистые тромбы, закупоривающие неповрежденные сосуды (тромботические состояния, тромбофилии).
Фибринолиз.Тромб в течение нескольких дней после образования рассасывается. Главная роль в его растворении принадлежит протеолитическому ферменту плазмину. Плазмин гидролизирует в фибрине пептидные связи, образованные остатками аргинина и триптофана, причём образуются растворимые пептиды. В циркулирующей крови находится предшественник плазмина – плазминоген. Он активируется ферментом урокиназой, который содержится во многих тканях. Пламиноген может активироваться калликреином, также имеющимся в тромбе. Плазмин может активироваться и в циркулирующей крови без повреждения сосудов. Там плазмин быстро инактивируется белковым ингибитором α2— антиплазмином, в то время как внутри тромба он защищён от действия ингибитора. Урокиназа – эффективное средство для растворения тромбов или предупреждения их образования при тромбофлебитах, тромбоэмболии легочных сосудов, инфаркте миокарда, хирургических вмешательствах.
Противосвёртывающая система.При развитии системы свёртывания крови в ходе эволюции решались две противоположные задачи: предотвращать вытекание крови при повреждении сосудов и сохранять кровь в жидком состоянии в неповреждённых сосудах. Вторая задача решается противосвёртывающей системой, которая представлена набором белков плазмы, ингибирующих протеолитические ферменты.
Белок плазмы антитромбин IIIингибирует все протеиназы, участвующие в свёртывании крови, кроме фактораVIIа. Он не действует на факторы, находящиеся в составе комплексов с фосфолипидами, а только на те, которые находятся в плазме в растворённом состоянии. Следовательно, он нужен не для регуляции образования тромба, а для устранения ферментов, попадающих в кровоток из места образования тромба, тем самым он предотвращает распространение свёртывания крови на поврежденные участки кровеносного русла.
В качестве препарата, предотвращающего свёртывание крови, применяется гепарин. Гепарин усиливает ингибирующее действие антитромбина III: присоединение гепарина индуцирует конформационные изменения, которые повышают сродство ингибитора к тромбину и другим факторам. После соединения этого комплекса с тромбином гепарин освобождается и может присоединяться к другим молекулам антитромбинаIII. Таким образом, каждая молекула гепарина может активировать большое количество молекул антитромбинаIII; в этом отношении действие гепарина сходно с действием катализаторов. Гепарин применяют как антикоагулянт при лечении тромботических состояний. Известен генетический дефект, при котором концентрация антитромбинаIIIв крови вдвое меньше, чем в норме; у таких людей часто наблюдаются тромбозы. АнтитромбинIII– главный компонент противосвёртывающей системы.
В плазме крови есть и другие белки – ингибиторы протеиназ, которые также могут уменьшать вероятность внутрисосудистого свёртывания крови. Таким белком является α2— макроглобулин, который ингибирует многие протеиназы, и не только те, которые участвуют в свёртывании крови. α2-Макроглобулин содержит участки пептидной цепи, которые являются субстратами многих протеиназ; протеиназы присоединяются к этим участкам, гидролизируют в них некоторые пептидные связи, в результате чего изменяется конформация α2-макроглобулина, и он захватывает фермент, подобно капкану. Фермент при этом не повреждается: в комплексе с ингибитором он способен гидролизировать низкомолекулярные пептиды, но для крупных молекул активный центр фермента не доступен. Комплекс α2-макроглобулина с ферментом быстро удаляется из крови: время его полужизни в крови около 10 мин. При массивном поступлении в кровоток активированных факторов свёртывания крови мощность противосвёртывающей системы может оказаться недостаточной, и появляется опасность тромбозов.
Витамин К.В пептидных цепях факторовII,VII,IX, иXсодержится необычная аминокислота — γ-карбоксиглутаминовая. Эта аминокислота образуется из глутаминовой кислоты в результате посттрансляционной модификации указанных белков:
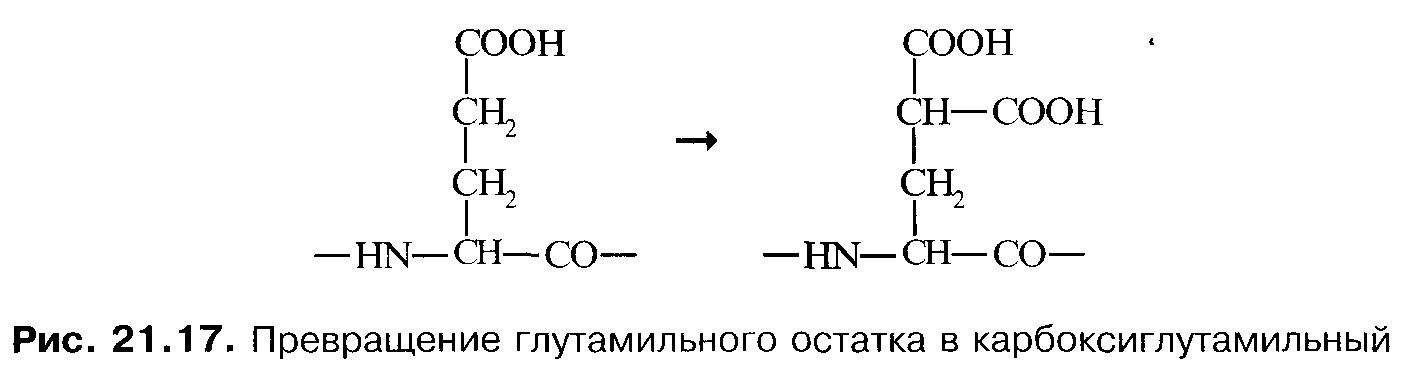
Реакции, в которых участвуют факторы II,VII,IX, иX, активируются ионами Са 2+ и фосфолипидами: радикалы γ-карбоксиглутаминовой кислоты образуют центры связывания Са 2+ на этих белках. Перечисленные факторы, а также факторыV’ иVIII’ прикрепляютя к бислойным фосфолипидным мембранам и друг к другу при участии ионов Са 2+ , и в таких комплексах происходит активация факторовII,VII,IX, иX. Ион Са 2+ активирует также и некоторые другие реакции свёртывания: декальцинированная кровь не свёртывается.
Превращение глутамильного остатка в остаток γ-карбоксиглутаминовой кислоты катализируется ферментом, коферментом которого служит витамин К. Недостаточность витамина К проявляется повышенной кровоточивостью, подкожными и внутренними кровоизлияниями. В отсутствие витамина К образуются факторы II,VII,IX, иX, не содержащие γ-карбоксиглутаминовых остатков. Такие проферменты не могут превращаться в активные ферменты.